
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Дебиеттер тізімі 8 страница
|
|
|
|
Cr(OH)3 HCrO2 H2CrO4 H2Cr2O7
Cr2(SO4)3 KCrO2 K2CrO4(pH>7) K2Cr2O7(pH<7)
pH<7 pH>7
7N 1S22S2p3
| ↑↓ | ↓ | ↓ | ↓ |
тотықсыздандырғышN-3 N0 N+1 N+2 N+3 N+4 N+5 тотықтырғыш
 NH3 N2 N2O NO N2O3 NO2 N2O5
NH3 N2 N2O NO N2O3 NO2 N2O5
HNO2 HNO3
KNO2 КNO3
(HNO2+HNO3)
Сонымен, Сr+6 тек тотықтырғыш, ол 3 «ең-ды қосып алады. Тек K2Cr2O7 молекуласында екі Сr+6, болғандықтан, ол барлығы 6 «ең қосып алады.
Азот N+3 – бұл жағдайда 2 «ең қосып алып, N+4 емес N+5-ке айналады, себебі N+4 екі қышқылға бірдей жатады. Ол күрделі оксид 4NO2 =N2O3+N2O5= N4O8 түзеді және жоғарыда айтылған жағдайда түзілмейді. Сонымен электрондық процесс мынадай болады:
 2Сr+6+2*3e=2Cr+3 1
2Сr+6+2*3e=2Cr+3 1
N+3-2e=N+5 3
Қосып алған «ең саны 6, ал беріп жіберген «ең саны 2. Екеуіне ортақ ең кішкентай сан 6, азот үшін коэффициент 6/2=3-ке тең болады.
Реакция нәтижесінде түзілген заттарды тек ережеге сәйкес жазу керек:
1) Сr+3 рН<7 ортада орта тұз – Сr2(SO4)3 түзеді;
2) N+5 оттекпен тартылып ең жоғары қышқыл анионын NO3- түзеді, ал оның тұзы KNO3;
3) K2Cr2O7 құрамындағы K+ тұздың ыдырау нәтижесінде рН<7 SO4-2 анионымен орта тұз - K2SO4 түзеді;
4) рН<7 ортада K2Cr2O7 құрамындағы оттекпен H2SO4 құрамындағы сутек су - Н2О түзеді.
Сонымен, K2Cr2O7+3KNO2+4H2SO4(p)=Cr2(SO4)3+3KNO3+K2SO4+4H2O
Табылған коэффициент 3 КNO2 мен KNO3-тің алдына қойылады, қалған коэффициенттер Ломоносов заңы бойынша, яғни атомдар балансы бойынша қойылады.
Бұл әдіс – «электрондық баланс әдісің деп аталады, бірақ әдіс өте дәл әдіс емес, себебі иондарды дұрыс көрсете алмайды. Мысалы: Cr+6 деген ион жоқ, Сr2O72- деген анион бар. Сол секілді N+3 жоқ, NO2- анион бар. Сондықтан ТТР-ның теңдігін құрастырудың басқа әдісі бар, ол электрондық – иондық байланыс әдісі немесе жартылай реакция әдісі.
|
|
|
K2Cr2O7+3KNO2+4H2SO4(p)=Cr2(SO4)3+3KNO3+K2SO4+4H2O
Осы жоғарыда қаралған таныс реакцияны иондық байланыс әдісімен теңестіріп көрейік.
1) Cr2O72- →2Cr3+.
Бұл әдіс реакцияның оң және сол жақ бөліктеріндегі атомдар балансына әкеліп соғады. ТТР рН<7 ортада жүргендіктен суды қолдануға болады. Реакцияның оң жақ бөлігіне сол жақ бөлігіндегі оттегінің санына байланысты 7 моль су қосамыз:

 Cr2O72-+14Н++6е→2Сr3++7Н2О
Cr2O72-+14Н++6е→2Сr3++7Н2О
+12 +6
Реакцияның оң жағында 14Н+ пайда болғандықтан сол жағын баланс үшін теңестіріп жазамыз. Енді зарядтар балансын тексереміз.

 2) NO2-+H2O-2e→NO3-+2H+
2) NO2-+H2O-2e→NO3-+2H+
- +
Екінші теңдікте де сол жақта жетіспеген оттегі Н2О көмегімен енгізіледі де оң жаққа 2Н+ қосыладф, зарядтар балансы (-2е).
Осы теңдіктерді қатар жазып беріп жіберген және қосып алған «ең балансы үшін қойылатын коэффициентті табамыз:
 Cr2O72-+14Н++6е=2Сr3++7Н2О
Cr2O72-+14Н++6е=2Сr3++7Н2О
3 NO2-+H2O-2e=NO3-+2H+
Коэффициентті 3-ке көбейтіп екі теңдікті біреу етіп жазамыз, ол үшін «+6ең мен «-6ең қысқартамыз:
Cr2O72- +14Н++3NO2-+3H2O =2Cr+3+7H2O+ 3NO3- +6H+
8 4 3K+
2K+ 4SO42- 3K+ 3SO42- 2K++SO42-
Жетіспей тұрған K+ катионы мен SO42- анионын қосып толық реакция теңдігін жазамыз:
K2Cr2O7+4H2SO4+3KNO2=Cr2(SO4)3+4H2O+3KNO3+K2SO4
Иондық баланс әдісінің жетістігі:
1. ионның дұрыс түрін жазу (Сr+6 емес Cr2О7-2);
2. судың дұрыс орны;
3. зат формулаларының алдына бірден коэффициенттері жазылады.
Негізгі әдебиет: [1] 225-232б; [2] – 246-267б; [3] - 251-259б; [4] – 230-251б; [5] – 143-148б; [6] – 184-188б.
Қосымша әдебиет: [8] – 58-67б.
Бақылау сұрақтары:
1. Тотығу дәрежесі дегеніміз не?
2. Қандай элементтердің атомдарында тұрақты тотығу дәрежесі бар?
3. «Тотығу-тотықсыздану реакцияларың деп қандай реакцияны айтамыз? Мысал келтіріңіз.
|
|
|
4. «Тотықтырғышң және «тотықсыздандырғышң дегеніміз не? Мысал келтіріңіз.
5. ТТР қандай түрлерін білесіз?
6. Электрондық баланс әдісі нені білдіреді?
7. ТТР теңдігін құруда ионды-электронды әдіс нені білдіреді? Электронды баланс әдісі алдында оның қасиеттерін атаңыз.
VІІІ. Дәріс тақырыбы: Электрохимияның негіздері (1 сағ.).
Дәріс конспектілері:
Электродтық потенциалдар. Сутектік жартылай элемент. Металдардың электрохимиялық қатары.
Сынаптан басқа металдардың құрылысы кристалды. Кристалдық тордың түйінінде атомдар немесе метал иондары болады. Металл пластинасын полярлы еріткіш суға батырса, метал пластинасы бет жағындағы электрондарын жоғалтады. Бұл кулондық тартылу күші нәтижесінде металл катионы мен пластинаға өзінің теріс жағымен орналасқан су диполі арасында болады. Металл катиондары суға кетеді де, пластина бетінде электрондар қалады және моноэлектрондық қабат түзеді. Пластина теріс зарядталады. Пластина бетіне моноиондық қабат түзген оң зарядталған гидратталған иондар тартылады.
 Zn0-2е=Zn+2+H2O [Zn(H2O)n]2+
Zn0-2е=Zn+2+H2O [Zn(H2O)n]2+
Фазалардың электрод-ертінді арасында қос электрлі қабат түзіледі де потенциал j өсіп кетеді. Егер суды 1М металл тұзына ауыстырса (мысалы ZnSO4), онда барлық параметрлер (m,t0) тұрақты болса, металл белгілі мөлшерде ериді және потенциалдық өсуі де тұрақты болады. 1М ертіндіде фазалар арасындағы түзілген потенциал металдың «стандартты электродтық потенциалың деп аталады және j0 деп белгіленеді. Барлық металдардың потенциалдары өлшенген және металдардың электрохимиялық активтілігінің қатары – кернеу қатары жасалған. Бұл қатар сілтілік металдардан басталады. Потенциалдары оң және теріс металдар потенциалы 0-ге тең сутекпен бөлінген
| Lі | Rb | K | Cs | Ba | Ca | Na | Mg | Al | Mn |
| -3.045 | -2.925 | -2.925 | -2.923 | -2.90 | -2.87 | -2.71 | -2.37 | -1.7 | -1.18 |
| Zn | Cr | Fe | Cd | Co | Nі | Sn | Pb | H | Cu |
| -0.76 | -0.74 | -0.44 | -0.40 | -0.28 | -0.25 | -0.14 | -0.13 | ±0 | +0.34 |
| Ag | Hg | Au | |||||||
| +0.80 | +0.85 | +1.50 |
Кернеу қатарынан екі жағдай туады: 1) сутекке дейін тұрған металдар тотықтырғыш емес қышқылдар құрамынан сутекті ығыстырып шығарады; 2) алдында (сол жақта) орналасқан металл кейін (оң жақта) тұрған металды ығыстырып шығарады.
|
|
|
1) Zn+2HCl=ZnCl2+H2
2) Cd+CuSO4=CdSO4+Cu.
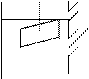
Электродтық потенциалды өлшеу үшін сутектік жартылай элементті қолданады. Жартылай элемент – электродтан (металл пластинкасы) және электролит ертіндісінен тұратын жүйе. Сутектік жартылай элемент тегіс платина бетіне престелген платина үнтағын жаққан көптеген майда кеуектері бар платинадан және платина үнтағының майда кеуектеріне адсорбцияланған газ күйіндегі сутектен тұрады.
 |

|
|
Осылардың бәрі иондарға – Н2SO4=2H++SO4-2 диссоциацияланған 1М Н2SO4 ертіндісіне батырылады. Pt мен жанасқан ертіндінің газ-сұйықтық бөлінген арасында потенциал 2Н/2Н+ өсіп кетеді, яғни асқын потенциал туады. Оны өлшеу мүмкін емес, сондықтан оны jН20=0,00В деп алады. Сутектің нөлге тең потенциалына салыстырылып металдардың потенциалдары өлшенген және ол «металл потенциалың деп бекітілген.
Гальваникалық элементтер теориясы
Екі жартылай элементтен тұратын жүйе «гальваникалық элементң деп аталады. Гальваникалық элементте бір электрод ериді, екіншіде металдар немесе сутегі катиондары тотықсызданады.
Мысалы:
 |
Zn0 Zn+2 Cu+2 Cu0
Потенциал Zn EZn0= -0.76B, потенциал Cu ECu0= +0.34B.
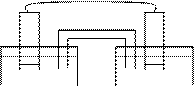
Zn-электродының потенциалы теріс таңбалы болғандықтан ол активтілеу, ериді және электрондар цинк пластинасынан бірінші ретті өткізгіш пен өлшегіш құрал арқылы екінші мыс электродына ағады, онда мыс катиондары тотықсызданады (3 сурет).
|
 |
|

 Процестің химизмі: І ІІ
Процестің химизмі: І ІІ
|
|
|
Zn0-2e=Zn2+, тотықсыздандырғыш.
Cu2++2e=Cu0, тотықтырғыш.
Гальваникалық элементтің электр қозғаушы күші ЭҚК, яғни потенциалдар айырмашылығы УҚР ретінде табылады. ЭҚК =Ет-ш-Ет-сызд-ш, ЭҚК – мәні барлық уақытта оң таңбалы. Сонымен
эдс=ECu0 – EZn0 =+0.34-(-0.76)=1.1B.
Бірінші ыдыста мырыштың еруі Zn2+ концентрациясымен шектеледі, концентрациясы өте жоғары болғанда ертінді оң зарядталады да, процесс тоқтайды. Оны «оң полярлауң дейді.Екінші ыдыста уақыт өткен сайын SO42- аниондары көбейеді. Мыс катиондары тотықсызданатындықтан теріс поляризация түзіледі және мұнда да процесс тоқтайды. «+ң және «-ң поляризация болғызбау үшін екі ыдыс U-тәрізді трубкамен қосылады. Осы трубка арқылы аниондар екінші ыдыстан бірінші ыдысқа ауысады, иондар тепе-теңдігі пайда болады да процесс ары қарай жүреді.
Егер тұздар концентрациясы 1М емес, басқалай болса, онда электродтар потенциалдары Нернст формуласын пайдаланып табылады. Оның көрінісі мынандай:
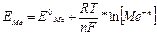
Тұрақтылар R,T,F мәнін қойып және ln=2.303lg есептеп, мынадай формула аламыз:

мұнда n – металл валенттілігі немесе электрондар саны.
Есеп: Fe/Fe2+(10-3моль/л) // Sn2+(10-1моль/л) / Sn жүйесінің Эқк-н табыңыз.
Нернст формуласын пайдаланып темір мен қалайының потенциалдарын табамыз::
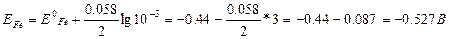
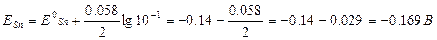
УҚК=ЕSn-ЕFe=-0.169-(-0.527)=+0.358B
Гальваникалық элементтер – токтың химиялық көздері. Олар тотығу-тотықсыздану реакциялары арқылы электроток туғызады. Бұл реакциялар «электрохимиялық реакцияларң деп аталады.
Электролиз.
Электролиз процесі кезінде, керісінше тотығу-тотықсыздану процесі сыртқы ток көмегімен жүреді. Электролиз дегеніміз – электролит арқылы электроток өткенде жүретін тотығу-тотықсыздану процесі. Электролиз жүруі үшін электролиздер (пішіні кез-келген стакан, колба, көбінесе U-трубка және т.б.) және электродтар керек. Электрод ретінде өздері процеске қатыспайтын, яғни индифферентті тек электрондарды өткізетін престелген графит стержендер бола алады. Сонымен қатар, анодтық еру процесіне қатысатын метал стержендері де электрод болады. Электролит ретінде тұздардың судағы еітінділері мен балқымалары қызмет атқарады.
Электролит табиғатына және электролит материалына байланысты электролиздің үш түрі бар:
1) судағы ертіндінің индиффрентті электрод арқылы электролизі;
2) балқымалар электролизі;
3) еритін анодпен электролиз, яғни рафинадтау – металдарды тазалау.
І-түр – көмір стержені арқылы судағы ертінділердің электролизі.
Электролиздің металл (катион) потенциалына және табиғатына, анион потенциалына байланысты процестің төрт жағдайын байқауға болады:
Иондардың тотығу-тотықсыздануының ретін есте сақтау керек. Иондар катодта – теріс, электродта тотықсызданады, сондықтан «катодң деп аталады. Ал анодта аниондар тотығады, сондықтан «анодң деп аталады.
|

-
K
Катодта потенциалы оң катодтар тотықсызданады. Бұған металдардың кернеу қатарының аяғында орналасқан металл катиондары жатады:
| Au3+ | Hg2+ | Ag+ | Cu2+ | H+ |
| +1.5 | +0.85 | 0.80 | +0.34 | ±0 |
Металдардың кернеу қатарының бас жағында орналасқан металл катиондары ешуақытта тотықсызданып бөлініп шықпайды, себебі олардан оңай потенциал нөлге немесе өте кішкентай теріс потенциалы бар Н+ катионы тотықсызданып бөлініп шығады. Сонымен Lі-ден Al-ге дейін сулы ортада металл бөлінбейді:
| Lі+ | Rb+ | … | Al3+ |
| -3.045 | -2.925 | -1.7 |

H+(EH20=0.0B немесе Е0Н2 рН=7= -0,41В).
рН=7 кезіндегі сутек потенциалын Нернст формуласы бойынша есептеп шығаруға болады:
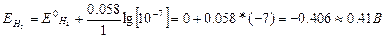
Zn-тен Pb-ға дейінгі металдардың электродтық потенциалдары рН»7 кезіндегі сутегінің потенциалына жақын, сондықтан бұл металдар сутегімен бірге бөлінеді.
Анодтық тотығу да біртіндеп өзінің орнымен жүреді. Потенциалы неғұрлым теріс болса, соғұрлым анодтар қиын тотығады. Мысалы, аниондардың потенциалдарға байланыстылығы мынадай:
| Ион | S2- | 2І- | 2Br- | 2Cl- | 2O2- | 2F- |
| Еокисл | +0.506 | -0.534 | -1.086 | -1.958 | -1.229 | -2.85 |
Оттектік аниондар: SO42-, NO3-, PO43-, CO32- және т.б. сулы ортада ешуақытта тотықпайды, олардың орнына судың О-2 ионы тотығады. Н2О-ң тотығу-тотықсыздану потенциалы мынадай:
 Тотықсыздану процесі Евосс= -0,828В 2Н2О+2е=Н2+2ОН-
Тотықсыздану процесі Евосс= -0,828В 2Н2О+2е=Н2+2ОН-
Тотығу процесі Еок = -1,229В 2Н2О –4е=О2+4Н+
а) CuSO4 ертіндісінің электролизі
Диссоциациясы CuSO4=Cu2++SO42-.
Диссоциациясы Н2О=Н++ОН-.
Катодтық процесс (-) Cu2++2e=Cu0. Анодтық процесс (+) SO42- тотықпайды, бөлінбейді
Н+ 2Н2О-4е=О20+4Н+
Электролизерде: 2Н++SO42-=H2SO4
в) AuCl3 электролизі (заттарды алтындау).
Диссоциациясы AuCl3=Au3++3Cl-.
Диссоциациясы Н2О=Н++ОН-.
(-) Au3++3e=Au0. (+)2Cl- -2e=Cl20.
H+ OH-
 Электролизерде: Н++ОН-=Н2О
Электролизерде: Н++ОН-=Н2О
с) KBr электролизі – өндірісте сілтілер алу әдісі.
Диссоциациясы KBr=K++Br-.
H2O=H++OH-
(-) К+ не восст. (+) Br-.
2H++2e=H2 OH-
2H2O+2e=H2+2OH- 2Br- -2e=Br20.
 |
Электролизерде К++ОН-=КОН
д) Na2SO4 тұзының ертіндісі, өндірісте Н2 алу әдісі.
Диссоциациясы Na2SO4=2Na++SO42-
H2O=H++OH-
K(-) 2Na+ не разр. (+) SO4-2 не разр.
2Н++2е=Н2 2ОН- -2е=Н2О+О
 2Н2О+2е=Н2+2ОН- 2Н2О-4е=О2+4Н+
2Н2О+2е=Н2+2ОН- 2Н2О-4е=О2+4Н+
Электролиздерде 2Na++SO42-=Na2SO4
Сонымен, көмір стерженімен судағы ертінділердің электролиздерінде электролиздің 4 жағдайы болуы мүмкін, нәтижесінде қышқыл су, сілті немесе тұз түзіледі.
ІІ-түрі – балқымалардың электролизі.
Сусыздандырған тұздарды қыздырып алынатын, агрегаттық күйі сұйық тұздарды «балқымаларң дейді. Ертінді секілді балқымалар да иондарға диссоциацияланады.
Су катиондары болмағандықтан балқымалардың электролизі жоғары кернеуде жүреді.
NaCl балқымасының электролизі – сілтілік металдарды өндірісте алу әдісі.
NaCl=Na++Cl-
(-) 2Na++2e=2Na0 (+)2Cl- -2e=Cl20
ІІІ түрі – еритін анодпен тазалау электролизі, металдарды рафинаттау.
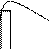
Электролиздің бұл түрінде басқа металдар қоспасы бар еритін анод қолданылады. Анодтың еруі және катодтағы тотықсыздану бақыланып тұратын белгілі бір потенциалда жүреді. Сондықтан анод металы және қоспалары ертіндіге көшеді, бірақ катодта негізгі металл тотықсызданады. Металдарды басқа қоспалардан осылай тазартады. Мысалы: мысты рафинаттау.
 | |||
 |


 -
-
 |
Анодта қоспасы бар таза емес мыс тотығады:
(+) Cu0 -2e=Cu2+
(-) Cu2 ++2e=Cu0
Катодта тек мыс катиондары тотықсызданады. Қоспалар ерітіндіде қалып қояды.
Фарадей заңдары.
І заңы. Электродта бөлінген заттың массасы электролит арқылы өткен ток мөлшеріне тура пропорционал m=І*t
m – граммен алынған масса;
І – ток күші, А;
t - секундпен өлшенген уақыт.
ІІ заңы. Электролиз кезінде токтың бірдей мөлшері электродтарда әртүрлі заттардың эквиваленттілік массасын бөліп шығарады.
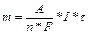
А – атомдық масса;
n – «ең саны, яғни оның қосылыстардағы заряды;
F – Фарадей саны=96500Кл.
Металдар коррозиясы.
Металдардың өзін қоршаған орта әсерінен бұзылуын (тотығуын) «коррозияң деп атайды. Металдардың немесе металл конструкцияларының оларға әсер ететін ортасы ауа, электролит, жер асты немесе электроток болуы мүмкін. Ортаға байланысты коррозияның бірнеше түрін ажыратуға болады.
1) химиялық немесе газ әсері;
2) электрохимиялық;
3) жер асты;
4) адасып жүрген ток (жер астында) арқылы коррозия.
Химиялық немесе газ әсерінен коррозия ауада жүреді. Ауа құрамы мынадай:
N2 (78.08%), O2 (20.95%), CO2 (0.03%), H2O, H2 (5*10-5%), H2S, SO2, SO3, NO, N2O3, NO2, Cl2, NH3 және т.б.
Ауада металл бірден тотықтырғыштардың, көбінесе оттегінің әсеріне ұшырайды. Мысалы: темір, созылған ыстық темір бірден тотығып оксид береді.
2Fe+O2=2FeO, ары қарай тотығып,
4FeO+O2=2Fe2O3 жартылай оксид түзеді, ол барлық қышқыл оксидтерімен және сумен әрекеттеседі. Сонымен, темір оксидінің барлық бағытта қышқыл оксидтерімен, күкіртсутекпен және сумен әрекеттесу реакциялары жүреді. Нәтижесінде тұз және «татң деп аталатын күрделі оксид Fe3O4 түзіледі. Бұл заттар майда кристалды, метал бетінен оңай ұшып кетеді де, металдың таза беті ары қарай тотығады.
|
|
|
|
|
Дата добавления: 2014-11-25; Просмотров: 746; Нарушение авторских прав?; Мы поможем в написании вашей работы!