
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Характеристика вагонов 81-717(714) 9 страница
100. Ряд напряжений металлов. Если из всего ряда стандартных электродных потенциалов выделить только те электродные процессы, которые отвечают общему уравнению
Мг+ + ze~ = М
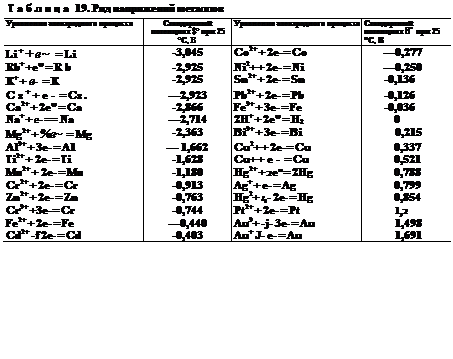
то получим ряд напряжений металлов. В этот ряд всегда помешают, кроме металлов, также водород, что позволяет видеть,
какие металлы способны вытеснять водород из водных раствороз кислот. Ряд напряжений для важнейших металлов приведен в табл. 19. Положение того или иного металла в ряду напряжений характеризует его способность к окислительно-восстановительным взаимодействиям в водных растворах при стандартных условиях. Ионы металлов являются окислителями, а металлы в виде простых веществ — восстановителями. При этом, чем дальше расположен металл в ряду напряжений, тем более сильным окислителем в водном растворе являются его ионы, и наоборот, чем ближе металл к началу ряда, тем более сильные восстановительные свойства проявляет простое вещество — металл. Потенциал электродного процесса
2Н+ + 2е~ = Н,
в нейтральной среде (рН=7) равен —0,059-7 = —0,41 В (см. стр. 273). Активные металлы начала ряда, имеющие потенциал, значительно более отрицательный, чем —0,41 В, вытесняют водород из воды. Магний вытесняет водород только из горячей воды. Металлы, расположенные между магнием и кадмием, обычно не вытесняют водород из воды. На поверхности этих металлов образуются оксидные пленки, обладающие защитным действием *.
Металлы, расположенные между магнием и водородом, вытесняют водород из растворов кислот. При этом на поверхности некоторых металлов также образуются защитные пленки, тормозящие реакцию. Так, оксидная пленка на алюминии делает этот металл стойким не только в воде, но и в растворах некоторых кислот. Свинец не растворяется в серной кислоте при ее концентрации ниже 80%, так как образующаяся при взаимодействии свинца с серной кислотой соль PbSO,} нерастворима и создает на поверхности металла защитную пленку. Явление глубокого торможения окисления металла, обусловленное наличием на его поверхности защитных оксидных или солевых пленок, называется пассивностью, а состояние металла при этом — пассивным состоянием.
| * Потенциалы металлов в воде, конечно, отличны от их потенциалов в стандартных условиях; в большинстве случаев они имеют более отрицательное значение. Но, как правило, это не сказывается на правильности выводов о способности металлов вытеснять водород из воды. |
Металлы способны вытеснять друг друга из растворов солей. Направление реакции определяется при этом их взаимным положением в ряду напряжений. Рассматривая конкретные случаи таких реакций, следует помнить, что активные металлы вытесняют водород не только из воды, но и из любого водного раствора. Поэтому взаимное вытеснение металлов из растворов их солей практически происходит лишь в случае металлов, расположенных в ряду после магния.
130. Ряд напряжений металлов
Вытеснение металлов из их соединений другими металлами впервые подробно изучал Бекетов *. В результате своих работ он расположил металлы по их химической активности в «вытеснитель* ный ряд», являющийся прототипом ряда напряжений металлов.
Взаимное положение некоторых металлов в ряду напряжений и в периодической системе на первый взгляд не соответствует друг, другу. Например, согласно положению в периодической системе химическая активность калия должна быть больше, чем натрия, а натрия — больше, чем лития. В ряду же напряжений наиболее активным оказывается литий, а калий занимает среднее положение между литием и натрием. Цинк и медь по их положению в периодической системе должны иметь приблизительно равную химическую активность, но в ряду напряжений цинк расположен значительно раньше меди. Причина такого рода несоответствий состоит в следующем.
При сравнении металлов, занимающих то или иное положение в периодической системе, за меру их химической активности — восстановительной способности — принимается величина энергии ионизации свободных атомов. Действительно, при переходе, например, сверху вниз по главной подгруппе I группы периодической системы энергия ионизации атомов уменьшается, что связано с увеличением их радиусов (т. е. с большим удалением внешних электронов от ядра) и с возрастающим экранированием положительного заряда ядра промежуточными электронными слоями (см. § 31). Поэтому атомы калия проявляют большую химическую активность — обладают более сильными восстановительными свойствами,-~ чем атомы натрия, а атомы натрия — большую активность, чем атомы лития.
| * Николай Николаевич Бекетов (1826—1911) — крупный русский ученый — физико-химик. Выдающимся трудом Бекетова являются его «Исследования над явлениями вытеснения одних элементов другими», опубликованные в 1865 г. Ои открыл свойство алюминия вытеснять при высокой температуре металлы из их. оксидов. Это открытие впоследствии легло в основу металлотермии (см. § 192), получившей широкое применение в металлургии. Бекетов осуществил многочисленные термохимические измерения. Ои впервые (с 1865 г.) ввел преподавание физической химии как учебной дисциплины. |
При сравнении же металлов в ряду напряжений за меру химической активности принимается работа превращения металла, находящегося в твердом состоянии, в гидратированные ионы в водном растворе. Эту работу можно представить как сумму трех слагаемых: энергии атомизации — превращения кристалла металла в изолированные атомы, энергии ионизации свободных атомов металла и энергии гидратации образующихся ионов. Энергия атомизации характеризует прочность кристаллической решетки данного металла. Энергия ионизации атомов — отрыва от них валентных электронов — непосредственно определяется положением металла в периодической системе. Энергия, выделяющаяся при гидратации, зависит от электронной структуры иона, его
заряда и радиуса. Ионы лития и калия, имеющие одинаковый заряд, но различные радиусы, будут создавать около себя неодинаковые электрические поля. Поле, возникающее вблизи маленьких ионов лития, будет более сильным, чем поле около больших ионов калия. Отсюда ясно, что ионы лития будут гидратироваться с выделением большей энергии, чем ноны калия.
Таким образом, в ходе рассматриваемого превращения затрачивается энергия на атомизацию и ионизацию и выделяется энергия при гидратации. Чем меньше будет суммарная затрата энергии, тем легче будет осуществляться весь процесс и тем ближе к началу ряда напряжений будет располагаться данный металл. Но из трех слагаемых общего баланса энергии только одно — энергия ионизации—непосредственно определяется положением металла в периодической системе. Следовательно, нет оснований ожидать, что взаимное положение тех или иных металлов в ряду напряжений всегда будет соответствовать их положению в периодической системе. Так, для лития суммарная затрата энергии оказывается меньшей, чем для калия, в соответствии с чем литий стоит в ряду напряжений раньше калия.
Для меди и цинка затрата энергии на ионизацию свободных атомов и выигрыш ее при гидратации ионов близки. Но металлическая медь образует более прочную кристаллическую решетку, чем цинк, что видно из сопоставления температур плавления этих Металлов: цинк плавится при 419,5 °С, а медь только при 1083 °С. Поэтому энергия, затрачиваемая на атомизацию этих металлов, существенно различна, вследствие чего суммарные энергетические затраты на весь процесс в случае меди гораздо больше, чем в случае цинка, что и объясняет взаимное положение этих металлов в ряду напряжений.
При переходе от воды к неводным растворителям взаимное положение металлов в ряду напряжений может изменяться. Причина этого лежит в том, что энергия сольватации ионов различных металлов по-разному изменяется при переходе от одного "растворителя к другому.
В частности, ион меди весьма энергично сольватируется в некоторых органических растворителях; это приводит к тому, что в таких растворителях медь располагается в ряду напряжений до водорода и вытесняет его из растворов кислот.
Таким образом, в отличие от периодической системы элементов, ряд напряжений металлов не является отражением общей Закономерности, на основе которой можно давать разностороннюю Характеристику химических свойств металлов. Ряд напряжений Характеризует лишь окислительно-восстановительную способность Электрохимической системы «металл — ион металла» в строго определенных условиях: приведенные в нем величины относятся i(c водному раствору, температуре 25 °С и единичной концентрации [(активности) ионов металла.
101. Электролиз. Электролизом называется совокупность процессов, происходящих при прохождении постоянного электрического тока через электрохимическую систему, состоящую из двух электродов и расплава или раствора электролита.
Примером электролиза может служить электролиз расплава хлорида магния. При прохождении тока через расплав MgCb катионы магния под действием электрического поля движутся к отрицательному электроду. Здесь, взаимодействуя с приходящими по внешней цепи электронами, они восстанавливаются
Mg2+ j_ 2е~ — Mg
Анионы хлора перемещаются к положительному электроду и, отдавая избыточные электроны, окисляются. При этом первичным процессом является собственно электрохимическая стадия — окисление ионов хлора
2СГ = 2С1 -f 1е~
а вторичным — связывание образующихся атомов хлора в молекулы:
2С1 = С12
Складывая уравнения процессов, протекающих у электродов, получим суммарное уравнение окислительно-восстановительной реакции, происходящей при электролизе расплава MgC^:
Mg2+ + 2СГ = Mg + Cl2
Эта реакция не может протекать самопроизвольно; энергия, необходимая для ее осуществления, поступает от внешнего источника тока.
Как и в случае химического источника электрической энергии, электрод, на котором происходит восстановление, называется катодом; электрод, на котором происходит окисление, называется анодом. Но при электролизе катод заряжен отрицательно, а анод—* положительно, т. е. распределение знаков заряда электродов противоположно тому, которое имеется при работе гальванического элемента. Причина этого заключается в том, что процессы, протекающие при электролизе, в принципе обратны процессам, идущим при работе гальванического элемента. При электролизе химическая реакция осуществляется за счет энергии электрического тока, подводимой извне, в то время как при работе гальванического элемента энергия самопроизвольно протекающей в нем химической реакции превращается в электрическую энергию.
При рассмотрении электролиза водных растворов нельзя упускать из виду, что, кроме ионов электролита, во всяком водном растворе имеются еще ионы, являющиеся продуктами диссоциации воды — Н+ и ОН-. В электрическом поле ионы водорода перемещаются к катоду, а ионы ОН- — к аноду. Таким образом, у катода могут разряжаться как катионы электролита, так и катионы водорода. Аналогично у анода может происходить разряд как анионов электролита, так и гидроксид-ионов. Кроме того, молекулы воды также могут подвергаться электрохимическому окислению или восстановлению.
Какие именно электрохимические процессы будут протекать у электродов при электролизе, прежде всего будет зависеть от относительных значений электродных потенциалов соответствующих электрохимических систем. Из нескольких возможных процессов будет протекать тот, осуществление которого сопряжено с минимальной затратой энергии. Это означает, что на катоде будут восстанавливаться окисленные формы электрохимических систем, имеющих наибольший электродный потенциал, а на аноде будут окисляться восстановленные формы систем с наименьшим электродным потенциалом. На протекание некоторых электрохимических процессов оказывает тормозящее действие материал электрода; такие случаи оговорены ниже.
Рассматривая катодные процессы, протекающие при электролизе водных растворов, ограничимся важнейшим случаем— катодным восстановлением, приводящим к выделению элементов в свободном состоянии. Здесь нужно учитывать величину потенциала процесса восстановления ионов водорода. Этот потенциал зависит от концентрации ионов водорода (см. стр. 273) и в случае нейтральных растворов (рН = 7) имеет значение Ш — =—0,059-7 = —0,41 В. Поэтому, если катионом электролита является металл, электродный потенциал которого значительно поло-жительнее, чем —0,41 В, то из нейтрального раствора такого электролита на катоде будет выделяться металл. Такие металлы находятся в ряду напряжений вблизи водорода (начиная приблизительно от олова) и после него. Наоборот, если катионом электролита является металл, имеющий потенциал значительно более отрицательный, чем —0,41 В, металл восстанавливаться не будет, а произойдет выделение водорода. К таким металлам относятся металлы начала ряда напряжений — приблизительно до титана. Наконец, если потенциал металла близок к значению —0,41 В (металлы средней части ряда — Zn, Сг, Fe, Cd, Ni), то в зависимости от концентрации раствора и условий электролиза * возможно как восстановление металла, так и выделение водорода; нередко наблюдается совместное выделение металла и водорода.
Электрохимическое выделение водорода из кислых растворов происходит вследствие разряда ионов водорода. В случае же нейтральных или щелочных сред оно является результатом электрохимического восстановления воды:
| * К важнейшим условиям электролиза относятся плотность тока, температура, состав раствора. Плотностью тока называется отношение силы тока к рабочей площади электрода, |
2Н20 + 2е~ = Н2 + 20Н"
101. Электролиз
Таким образом, характер катодного процесса при электролизе водных растворов определяется прежде всего положением соответствующего металла в ряду напряжений. В ряде случаев большое значение имеют рН раствора, концентрация ионов металла и другие условия электролиза.
При рассмотрении анодных процессов следует иметь в виду, что материал анода в ходе электролиза может окисляться. В связи с этим различают электролиз с инертным анодом и электролиз с активным анодом. Инертным называется анод, материал которого не претерпевает окисления в ходе электролиза. Активным называется анод, материал которого может окисляться в ходе электролиза. В качестве материалов для инертных анодов чаще всего применяют графит, уголь, платину.
На инертном аноде при электролизе водных растворов щелочей, кислородсодержащих кислот и их солей, а также фторо-водорода и фторидов происходит электрохимическое окисление воды с выделением кислорода. В зависимости от рН раствора этот процесс протекает по-разному и может быть записан различными уравнениями. В щелочной среде уравнение имеет вид
40Н" = 02 + 2Н20 + 4е~
а в кислой или нейтральной:
2Н20 = 02 + 4Н+ + 4е~
В рассматриваемых случаях электрохимическое окисление воды является энергетически наиболее выгодным процессом. Кислородсодержащие анионы или не способны окисляться, или их окисление происходит при очень высоких потенциалах. Например, стандартный потенциал окисления иона SO4-
2S02," = S2028" 4- 2е~
равен 2,01 В, что значительно превышает стандартный потенциал окисления воды (1,229 В). Стандартный потенциал окисления иона F~ имеет еще большее значение (2,866 В).
При электролизе водных растворов бескислородных кислот и их солей (кроме HF и фторидов) у анода разряжаются анионы. В частности, при электролизе растворов HI, НВг, НС1 и их солей у анода выделяется соответствующий галоген. Отметим, что выделение хлора при электролизе НС1 и ее солей противоречит взаимному положению систем
С12 4- 2е~ = 2СГ {&" =-- 1,358В)
и
02 4- 4Н+ 4- 4е~ = 2Н20 (&° = 1,229В)
в ряду стандартных электродных потенциалов. Эта аномалия связана со значительным перенапряжением (см. § 104) второго и
этих двух электродных процессов — материал анода оказывает тормозящее действие на процесс выделения кислорода.
В случае активного анода число конкурирующих окислительных процессов возрастает до трех: электрохимическое окисление воды с выделением кислорода, разряд аниона (т. е. его окисление) и электрохимическое окисление металла анода (так называемое анодное растворение металла). Из этих возмож- ' ных процессов будет идти тот, который энергетически наиболее выгоден. Если металл анода расположен в ряду стандартных потенциалов раньше обеих других электрохимических систем, то будет наблюдаться анодное растворение металла. В противном случае будет идти выделение кислорода или разряд аниона.
Рассмотрим несколько типичных случаев электролиза водных растворов.
Электролиз раствора СиС12 с инертным анодом. Медь в ряду напряжений расположена после водорода: поэтому у катода будет происходить разряд ионов Си2+ и выделение металлической меди. У анода будут разряжаться хлорид-ионы.
Схема электролиза* раствора хлорида меди(II):
СиС12
Катод — Си2+ 2СГ —>- Анод
Си2+ + 2е~ = [ей} 2СГ = 2С1 + 2е~
2С1 = ГсТТ|
Электролиз раствора K2SO4 с инертным анодом. Поскольку калий в ряду напряжений стоит значительно раньше водорода, то у катода будет происходить выделение водорода и накопление ионов ОН-. У анода будет идти выделение кислорода и накопление ионов Н+. В то же время в катодное пространство будут приходить ионы К+, а в анодное — ионы504~. Таким образом, раствор во всех его частях будет оставаться электронейтральным. Однако в катодном пространстве будет накапливаться щелочь, а в анодном — кислота.
Схема электролиза раствора сульфата калия:
2K2S04
Катод -<— 4К+ 2 SO2," —>- Анод
4Н20 + 4е-
4К+ 40Н"
+ 4Н
2Н20:
;oc/4 4Н+
+ 20 + 4е"
4Н= 2Н2
20 = О.
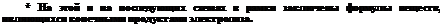
Ряс. 86. Схема установки, иллюстрирующей
закон Фарадея. *^^Ч
| CuClj |
| HCl AjNOj |
| SnCl4 |
Электролиз раствора NiS04 с никелевым анодом. Стандартный потенциал никеля (—0,250 В) несколько больше, чем —0,41 В; поэтому при электролизе нейтрального раствора NiSO( на катоде в основном происходит разряд ионов Ni2+ и выделение металла. На аноде происходит противоположный процесс — окисление металла, так как потенциал никеля намного меньше потенциала окисления воды, а тем более — потенциала
окисления иона SO4-. Таким образом, в данном случае электролиз сводится к растворению металла анода и выделению его на катоде.
Схема электролиза раствора сульфата никеля:
NiS04
Катод
SO:
Анод
№2+ +2е- = | N1
Ni
sor
+ 2е-
Этот процесс применяется для электрической очистки никеля (так называемое электролитическое рафинирование, см. § 103).
102. Законы электролиза. С количественной стороны процесс электролиза впервые был изучен в 30-х годах XIX века выдающимся английским физиком Фарадеем *, который в результате своих исследований установил следующие законы электролиза:
1. Масса образующегося при электролизе вещества пропорцио-
нальна количеству прошедшего через раствор электричества.
Этот закон вытекает из сущности электролиза. Как уже говорилось, в месте соприкосновения металла с раствором происходит электрохимический процесс—взаимодействие ионов или молекул электролита с электронами металла, так что электролитическое образование вещества является результатом этого процесса. Ясно, что количество вещества, получающегося у электрода, всегда будет пропорционально числу прошедших по цепи электронов, т. е. количеству электричества.
| * Майкл Фарадей (1791—1867)—один из крупнейших английских физиков и химиков. Большая часть его работ относится к области электричества. Он установил законы электролиза, открыл явление электромагнитной индукции. Впервые получил в жидком виде ряд газов (хлор, аммиак и др.), Открыл бензол и изобутилен. |
2. При электролизе различных химических соединений равные
количества электричества приводят к электрохимическому превра-
щению эквивалентных количеств веществ.
Пусть, например, электрический ток последовательно проходит через растворы соляной кислоты, нитрата серебра, хлорида медн(П) и хлорида олова(1У) (рис. 86). Через некоторое время определяют количества выделившихся продуктов электролиза. Оказывается, что за время, в течение которого из раствора соляной кислоты выделяется 1 г водорода, т. е. 1 моль атомов, из остальных растворов выделяются указанные ниже массы металлов:
Элет роллт
AgN03 CuCl2 SnCl4
Масса выделившегося на ка- 107,9 31,8 29,7
тоде металла, г
Атомная масса металла 107,87 63,55 118,69
Сопоставляя выделившиеся массы металлов с атомными массами тех же металлов, находим, что выделяется 1 моль атомов серебра, '/г моля атомов меди и 'Д моля атомов олова. Другими словами, количества образовавшихся на катоде веществ равны их эквивалентам. К такому же результату приводит и измерение количеств веществ, выделяющихся на аноде. Так, в первом, третьем и четвертом приборах выделяется по 35,5 г хлора, а во втором — 8 г кислорода; нетрудно видеть, что и здесь вещества образуются в количествах, равных их эквивалентам.
Рассматривая второй закон электролиза с точки зрения электронной теории, нетрудно понять, почему при электролизе вещества выделяются в химически эквивалентных количествах. Обратимся, например, к электролизу хлорида меди(II). При выделении меди из раствора каждый ион меди получает от катода два электрона, и в то же время два хлорид-иона отдают электроны аноду, превращаясь в атомы хлора. Следовательно, число выделившихся атомов меди всегда будет вдвое меньше числа выделившихся атомов хлора, т. е, массы меди и хлора будут относиться друг к другу, как их эквивалентные массы.
Измерениями установлено, что количество электричества, обусловливающее электрохимическое превращение одного эквивалента вещества, равно 96 485 (округленно 96 500) кулонам. Величина 96 500 Кл/моль называется постоянной Фарадея и обозначается буквой F.
Второй закон электролиза дает прямой метод определения эквивалентов различных элементов. На этом же законе основаны расчеты, связанные с электрохимическими производствами.
Законы электролиза относятся к электролизу растворов, расплавов и твердых электролитов с чисто ионной проводимостью.
103. Электролиз в промышленности. Важнейшее применение электролиз находит в металлургической и химической промышленности и в гальванотехнике.
В металлургической промышленности электролизом расплавленных соединений и водных растворов получают металлы, а так-
же производят электролитическое рафинирование — очистку металлов от вредных примесей и извлечение ценных компонентов.
Электролизом расплавов получают металлы, имеющие сильно отрицательные электродные потенциалы, и некоторые их сплавы.
При высокой температуре электролит и продукты электролиза могут вступать во взаимодействие друг с другом, с воздухом, а также с материалами электродов и электролизера. В результате этого простая, в принципе, схема электролиза (например, электролиз MgCl2 при получении магния) усложняется.
Электролитом обычно служат не индивидуальные расплавленные соединения, а их смеси. Важнейшим преимуществом смесей является их относительная легкоплавкость, позволяющая проводить электролиз при более низкой температуре.
В настоящее время электролизом расплавов получают алюминий, магний, натрий, литий, бериллий и кальций. Для получения калия, бария, рубидия и цезия электролиз расплавов практически не применяется из-за высокой химической активности этих металлов и большой их растворимости в расплавленных солях. В последние годы электролизом расплавленных сред получают некоторые тугоплавкие металлы.
Электролитическое выделение металла из раствора называется электроэкстракцией. Руда или обогащенная руда—концентрат (см. § 192)—подвергается обработке определенными реагентами, в результате которой металл переходит в раствор. После очистки от примесей раствор направляют на электролиз. Металл выделяется на катоде и в большинстве случаев характеризуется высокой чистотой. Этим методом получают главным образом цинк, медь и кадмий.
Электролитическому рафинированию металлы подвергают для удаления из них примесей и для перевода содержащихся в них компонентов в удобные для переработки продукты. Из металла, подлежащего очистке, отливают пластины и помещают их в качестве анодов в электролизер. При прохождении тока металл подвергается анодному растворению — переходит в виде катионов в раствор. Далее катионы металла разряжаются на катоде, образуя компактный осадок чистого металла. Содержащиеся в аноде примеси либо остаются нерастворенными, выпадая в виде анодного шлама, либо переходят в электролит, откуда периодически или непрерывно удаляются..
Рассмотрим в качестве примера электрорафинирование меди. Рсновным компонентом раствора служит сульфат меди — наиболее распространенная и дешевая соль этого металла. Но раствор (puS04 обладает низкой электрической проводимостью. Для ее увеличения в электролит добавляют серную кислоту. Кроме того, в раствор вводят небольшие количества добавок, способствующих Получению компактного осадка металла.
Металлические примеси, содержащиеся в неочищенной («черновой») меди, можно разделить на две группы:
1) Fe, Zn, Ni, Со. Эти металлы имеют значительно более отрицательные электродные потенциалы, чем медь. Поэтому они аиод-но растворяются вместе с медью, но не осаждаются на катоде, а накапливаются в электролите. В связи с этим электролит периодически подвергают очистке.
2) Au, Ag, Pb, Sn. Благородные металлы (Au, Ag) не претерпевают анодного растворения, а в ходе процесса оседают у анода, образуя вместе с другими примесями анодный шлам, который периодически извлекается. Олово же и свинец растворяются вместе с медью, но в электролите образуют малорастворимые соединения, выпадающие в ссадок и также удаляемые.
Электролитическому рафинированию подвергают медь, никель, свинец, олово, серебро, золото.
К гальванотехнике относятся гальваностегия и гальванопластика. Процессы гальваностегии представляют собой нанесение путем электролиза на поверхность металлических изделий слоев других металлов для предохранения этих изделий от коррозии, для придания их поверхности твердости, а также в декоративных целях. Из многочисленных применяемых в технике гальванотехнических процессов важнейшими являются хромирование, цинкование и никелирование.
Сущность гальванического нанесения покрытий состоит в следующем. Хорошо очищенную и обезжиренную деталь, подлежащую защите, погружают в раствор, содержащий соль того металла, которым ее необходимо покрыть, и присоединяют в качестве катода к цепи постоянного тока; при пропускании тока на детали осаждается слой защищающего металла. Наилучшая защита обеспечивается мелкокристаллическими плотными осадками. Такие осадки обладают, кроме того, лучшими механическими свойствами.
Гальванопластикой называются процессы получения точных металлических копий с рельефных предметов электроосаждением металла. Путем гальванопластики изготовляют матрицы для прессования различных изделий (граммофонных пластинок, пуговиц и др.), матрицы для тиснения кожи и бумаги, печатные радиотехнические схемы, типографские клише. Гальванопластику открыл русский академик Б. С. Якоби (1801—1874) в тридцатых годах XIX века.
К гальванотехнике относятся также другие виды электрохимической обработки поверхности металлов: электрополирование стали, оксидирование алюминия, магния. Последнее представляет собой анодную обработку металла, в ходе которой определенным образом изменяется структура оксидной пленки на его поверхности. Это приводит к повышению коррозионной стойкости металла. Кроме того, металл приобретает при этом красивый внешний вид.
В химической промышленности методом электролиза получают различные продукты; к числу их относятся фтор, хлор, едкий натр, водород высокой степени чистоты, многие окислители, в частности пероксид водорода.
104. Электрохимическая поляризация. Перенапряжение. Когда электрод находится при потенциале, равном равновесному, на нем устанавливается электрохимическое равновесие:
Ох + ze~ ^=fc Red
При смещении потенциала электрода в положительную или з отрицательную сторону на нем начинают протекать процессы окисления или восстановления. Отклонение потенциала электрода от его равновесного значения называется электрохимической п о л"Я ризацией или просто поляризацией.
|
|
Дата добавления: 2014-11-16; Просмотров: 521; Нарушение авторских прав?; Мы поможем в написании вашей работы!