
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Пример 3. Как измениться скорость прямой и обратной реакции 2 NO + O2 2NO2
|
|
|
|
Пример 2
Пример 1
Как измениться скорость прямой и обратной реакции 2 NO + O2  2NO2
2NO2
при увеличении давления в 3 раза при T = const.
| υ2/υ1 (прямой) -? υ2/υ1 (обратной) -? | В задаче используем закон действия масс υ = kРАа× РВb Прямая реакция (протекает слева направо) до увеличения Р υ 1 = kP 2 (NO)P(O 2 ) после увеличения Р υ 2 = k(3P(NO)) 2 ×3P(O 2 ) |
| Р2 = 3Р1 |

Скорость прямой реакции увеличится в 27 раз.
Для обратной реакции (справа налево):
υ1 = kP2(NO2); υ2 = k(3P2(NO2))2
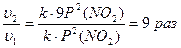
Скорость обратной реакции увеличится в 9 раз.
Константа распада Ra равна 3,79×10-3 с-1. Определить период полураспада и время, за которое Ra распадается на 90%.
| t1/2 -? t10% -? | Используем кинетическое уравнение первого порядка: 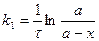 a = 100% (начальная максимальная концентрация Ra).
a-x = 100 – 90 = 10%
t10% = ( ln (a/(a-x)))/k I
t10% = (ln(100/10))/3,79×10-3 = 607c
t1/2 = ln2 /k I
t1/2 = ln2/3,79×10-3 = 183 c
a = 100% (начальная максимальная концентрация Ra).
a-x = 100 – 90 = 10%
t10% = ( ln (a/(a-x)))/k I
t10% = (ln(100/10))/3,79×10-3 = 607c
t1/2 = ln2 /k I
t1/2 = ln2/3,79×10-3 = 183 c
|
| kI = 3,79×10-3 c-1 x = 90% |
Во сколько раз увеличиться время, необходимое для завершения реакции, если повысить температуру на 40°С, температурный коэффициент равен 3.
| k2/k1 -? | Используем правило Вант Гоффа. k 2 /k 1 = g (t2-t1)/10 k 2 /k 1 = 340/10 = 34 = 81 Скорость увеличится в 81 раз. |
| g = 3 Dt = 40°C |
Вопросы для самоконтроля
1.Почему катализаторы увеличивают скорость химической реакции.
2.Приведите пример, когда порядок реакции не совпадает с молекулярностью.
3.Дайте энергетическую характеристику элементарного акта химической реакции.
|
|
|
|
|
Дата добавления: 2014-11-18; Просмотров: 1799; Нарушение авторских прав?; Мы поможем в написании вашей работы!