
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Механізми утворення донорно-акцепторного зв'язку
|
|
|
|
Комплексні координаційні сполуки.
Комплексними координаційними сполуками називаються такі сполуки, в яких поряд з іншими видами хімічного зв'язку є один або декілька донорно-акцепторних зв'язків (Д.А.З.).
Щоб утворився донорно-акцепторний зв'язок між двома контактуючими частинками (атомами, іонами, молекулами) необхідно, щоб одна частинка мала одну або декілька неподілених пар електронів у зовнішньому енергетичному рівні, а друга — вільні енергетичні орбіталі (комірки), як правило, у зовнішньому енергетичному рівні. Якщо такі частинки знаходяться у розчині, то зіткнувшись, вони утворюють Д. А. З. Механізм цього утворення полягає в тому, що одна частинка для утворення зв'язку надає неподілену пару електронів, а друга — вільну орбіталь (комірку). Утворення донорно-акцепторного зв'язку можна розглянути на такому класичному прикладі, як утворення комплексного іону амонію. Для цього треба провести реакцію між розчином соляної кислоти і розчином аміаку. У розчині соляної кислоти є вільні іони водню. Це практично протон водню, тому, що у нього немає електрона в енергетичному рівні, таким чином, орбіталь у нього вільна. У молекулі аміаку атом азота у зовнішньому енергетичному рівні має неподілену пару електронів. Якщо розчини соляної кислоти і аміаку злити разом, то в суміші будуть рухатись хаотично всі іони. Настане такий момент, коли іон водню зіткнеться з молекулою аміаку. Неподільна пара електронів азоту зайде в поле діяння ядра водню, тобто в орбіталь, а вийти з неї не зможе. Так утворився донорно-акцепторний зв'язок:
 H
H


 H N: +ٱH Cl→Hٱ←:N H→NH4+→|HNH3|Cl.
H N: +ٱH Cl→Hٱ←:N H→NH4+→|HNH3|Cl.
 H
H
Та частинка, яка надає для утворення донорно-акцепторного зв'язку енергетичну орбіталь (комірку),називається акцептором, а частинка, яка надає неподільну електронну пару, називається донором електронів.
|
|
|
Тема 3. Загальні закономірності хімічних процесів
Енергетика хімічних процесів. Енергетичні ефекти хімічних реакцій. Термохімія. Закон Гесса. Закони термодинаміки. Внутрішня енергія та ентальпія. Стандартна ентальпія утворення хімічних сполук. Ентропія та її зміна при хімічних процесах. Вільна енергія Гіббса та її зміна при хімічних процесах. Стандартна вільна енергія Гіббса утворення хімічної сполуки. Умови самочинного перебігу хімічних реакцій.
Хімічна кінетика та хімічна рівновага. Гомогенні та гетерогенні системи. Швидкість гомогенної реакції, її залежність від концентрації та температури. Константа швидкості реакції. Швидкість гетерогенних хімічних реакцій. Енергія активації. Каталіз. Хімічна рівновага в гомогенних системах. Константа хімічної рівноваги, її зв'язок із термодинамічними функціями. Зміщення рівноваги. Принцип Ле Шательє, його значення для технологічних процесів. Фазова рівновага, правило фаз. Адсорбція. Адсорбційна рівновага.
Термодинаміка – це наука про перетворення різних видів енергії в системах.
Система – це сукупність фізичних тіл, котрі взаємодіють між собою і в думці відокремлені від навколишнього середовища. Системи бувають: ізольовані, гетерогенні і гомогенні.
До ізольованих відносяться такі, для яких енергообмін і масообмін (з навколишнім середовищем) неможливий – це ідеальна система, яка в природі відсутня.
 До замкнутих відносяться системи, для яких масообмін неможливий, а енергообмін можливий.
До замкнутих відносяться системи, для яких масообмін неможливий, а енергообмін можливий.
До гомогенних відносяться такі системи, коли всі фізичні тіла системи, тобто вихідні матеріали і продукти реакції знаходяться в одному агрегатному стані Г-Г, Р-Р, Тв – Тв:
 .
.
До гетерогенних відносяться такі системи, коли фізичні тіла знаходяться в різних агрегатних станах 
|
|
|
Хімічна термодинаміка, як складова частина термодинаміки, розглядає теплові явища, як результат глибокої зміни в процесі розриву та утворення нового хімічного зв’язку. При цьому можливі 2 процеси: 1 – коли в результаті взаємодії виділяються тепло або енергія – такі процеси називаються екзотермічними; 2 – якщо поглинається енергія – ендотермічними.
Протікання процесів можливе при постійному об’ємі – ізохоричні, при постійному тиску – ізобаричні, при постійній температурі – ізотермічні. У залежності від проведення процесу треба вказувати параметри, тобто термодинаміка має свої закони.
1-й закон. В ізольованих системах зберігається закон збереження матерії та енергії.
Енергетична умова така: кількість енергії, підведеної до системи, витрачається на зміну внутрішньої енергії та можливість виконання роботи.
Q = ∆И + А,
де ∆И – зміна внутрішньої енергії;
Q – тепло;
А – робота.
∆И – це енергія всіх структурних одиниць системи (взаємодія електрон-ядро, протон-протон, нейтрон-протон, нейтрон-електрон, міжядрерна взаємодія).
Система: поршень-циліндр


 A =F(h2 – h1);
A =F(h2 – h1);

 F = P∙S;
F = P∙S;


 A = P∙S(h2 – h1); A = PΔИ.
A = P∙S(h2 – h1); A = PΔИ.




 h2
h2
h1
Перший закон термодинаміки:
A = PΔV +ΔИ.
При ізохиричному процесі, тобто V =const, перший закон читається, як QV =ΔИ.
При ізобаричному процесі, тобто
P = const; Qp = ΔИ + рΔV =И2 – И1 + РV2 – V1P =
И2 + РV2 – V1 + PV1 = ΔH – ентальпія.
Ентальпія – складна термодинамічна функція, котра показує зміну внутрішньої енергії та можливість виконання роботи при переході з одного стану в інший: ІН = кДж/моль.
Фізичний зміст
За першим законом термодинаміки: Ентальпія - тепловміст системи.
Ентальпія для систем від нас незалежних → прагне до mіп.
Для елементарних речовин ентальпія завжди дорівнює 0
(H2, O2, N2, Cl2).
Хімічна термодинаміка має свої два закони.
Закон Лавуазьє-Лапласа
Кількість енергії, котра виділяється при утворенні складної речовини дорівнює кількості енергії його розкладу, але з протележним знаком.
СаО + Н2О →Са(ОН)2 ≈ 50 кДж/моль
Н2 › Н1 =∆Н › 0 – енд.
Н2 ‹ Н1 = ∆Н ‹ 0 –екз.
Закон Гесса
Сумарний тепловий ефект будь-якої хімічної реакції не залежить від шляху протікання, а залежить від початкового та кінцевого стану.
|
|
|
У загальному вигляді для будь-якої хімічної реакції закон Гесса
аА + вВ → сС +dD,
де А, В – вихідні речовини;
C, D – продукти реакції, які одержані в ході процесу;
a, в, с, d –коефіцієнти.
Нхім.реак. = ∑∆Нкін. - ∑∆Нпоч.;
Hх.р. = (сНс + Нd) – (aHA + вНВ)
кінц. поч.
Виходячи із закону Гесса:
1 – можна визначити сумарний тепловий ефект;
2 – можна визначити, знаючи сумарний тепловий ефект реакції, ентальпію будь-якої кінцевої або початкової речовини.
Приклад. С2Н5ОН + 3О2 → 2СО2 + 3Н2О.
З таблиці ентальпій знайдено значення ∆Н із вхідних і кінцевих речовин.
∆Н = С2Н5ОН + 3О2→2СО2 + 3Н2О
235,31 0 -393,5 -215,9
Нх.р. = [2(-393,5) +3(-285,9)] - [(-235,31)] = -1409,39 кДж/моль.
Два початка термодинаміки
1) тепло від більш холодного тіла ніколи не перейде до більш нагрітого;
2) система завжди прагне до безладу.
 Ентропія – термодинамічна функція, котра являється мірою хаотичності або безладу в системі ∆S>0:
Ентропія – термодинамічна функція, котра являється мірою хаотичності або безладу в системі ∆S>0:
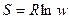 ,
,
де R –постійна Больцмана;
ln – основа натурального log;
w –імовірність системи w = f (P, V, T, C) – функція параметрів системи.
Фізичний зміст. Кількість енергії, яка припадає на 1оК
 [Дж/моль град].
[Дж/моль град].
За другим законом термодинаміки ентропія збільшується 
Гібс з’єднав перший і другий закони термодинаміки.
Кількість енергії, підведеної до системи, містить частку енергії, яку можна перетворити в корисну роботу (вільна енергія Гібса) і частка енергії губиться безповоротно.


 ,
,
де  вільна енергія Гібса;
вільна енергія Гібса;
 рівна
рівна  підведена енергія;
підведена енергія;
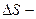 ентропія;
ентропія;
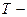 температура в К.
температура в К.
Фізичний зміст
Кількість енергії, підведеної до системи  , разом з енергією Гібса складає
, разом з енергією Гібса складає  .
.
Вільна енергія Гібса вимірюється в кДж.
На основі закону Гібса визначається напрямок хімічного процесу. При:
1) 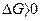 - процес неможливий;
- процес неможливий;
2)  - процес можливий;
- процес можливий;
3)  - процес рівноваги, тобто можливість початку процесу.
- процес рівноваги, тобто можливість початку процесу.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 803; Нарушение авторских прав?; Мы поможем в написании вашей работы!