
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хімічні джерела електричного струму
|
|
|
|
Гальванічні елементи.
Гальванічний елемент – це пристрій, що складається з двох електродів, у якому енергія хімічних реакцій перетворюється на електричну, тобто є джерело постійного електричного струму.
Розглянемо один приклад гальванічного елемента, що складається із стандартних цинкового і нікелевого електродів (цинкова і нікелева пластини занурені в 1 М розчині ZnSO4 і NiSO4 відповідно). Схему елемента можна записати так:
Zn /1M ZnSO4 // 1M NiSO4/Ni.
Значення стандартних електродних потенціалів цинку і нікелю:
E0(Zn2+ - /(Zn) = - 0,76 B;
E0(N2+/ (Ni) = - 0,25 B.
Значення Е0 свідчать про те, що цинк легше, ніж нікель, віддає електрони, тобто окислюється.
При замиканні електрохімічного кола почнуть відбуватися такі процеси: на електроді з більш негативним потенціалом (цинковим) – окислення металу; на електроді з більш позитивним потенціалом (нікелевому) – відновлення іонів металу, тобто
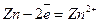 ;
; 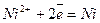 .
.
Сумарну реакцію у цьому гальванічному елементі скорочено можна записати так:
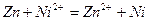 .
.
При окисленні цинку іони цинку переходять у розчин, а електрони залишаються в металі. По провіднику, що сполучає метали, ці електрони переходять на нікель і витрачаються в реакції відновлення іонів нікелю. Такі процеси відбуваються доти, доки увесь цинк не розчиниться або не використаються частинки, що можуть відновлюватися на нікелі. Отже, під час роботи гальванічного елемента на металічному провіднику, що сполучає два електроди, відбувається напрямлене переміщення електронів,
 тобто проходить електричний струм.
тобто проходить електричний струм.
Основною характеристикою гальванічного елемента є його електрорушійна сила – різниця електродних потенціалів у початковий момент роботи елемента (від більш позитивного електродного потенціалу віднімають більш негативний потенціал). У нашому прикладі отримаємо:
|
|
|
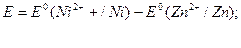
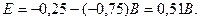
При послідовному сполученні гальванічних елементів можна отримати батарею з необхідною величиною електрорушійної сили.
Поширеним гальванічним елементом є елемент Даніеля-Якобі, що складається із стандартних цинкового і мідного електродів:
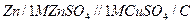 и.
и.
Під час записування схем гальванічних елементів звичайно зліва записують електрод із більш негативним значенням потенціалу, а справа – з більш позитивним. Якщо до складу електрохімічного кола входить водневий електрод, то його записують спочатку.
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 1226; Нарушение авторских прав?; Мы поможем в написании вашей работы!