
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Карбоновые кислоты
|
|
|
|
Карбоновыми кислотами называются производные углеводородов, в молекуле которых содержится одна или несколько карбоксильных групп –COOH.
Общая формула карбоновых кислот:
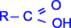
В зависимости от природы радикала, связанного с карбоксильной группой, кислоты подразделяются на предельные, непредельные и ароматические.
Число карбоксильных групп определяет основность кислот.
Общая формула предельных одноосновных кислот: СnH2n+1COOH (или СnH2nO2).
По женевской номенклатуре названия кислот составляются из названий углеводородов с тем же общим числом атомов углерода, что и в кислоте, с прибавлением окончания овая и слова кислота.
Ниже приведены названия некоторых кислот в следующем порядке: исторически сложившееся название, название по рациональной, затем по женевской номенклатуре (слово «кислота» везде опущено):
- НСООН - муравьиная (карбоновая, метановая);
- СН3СООН - уксусная (метанкарбоновая, этановая);
- С2Н5СООН - пропионовая (этанкарбоновая, пропановая);
- С3Н7СООН - масляная (пропанкарбоновая, бутановая).
Наиболее часто в практике встречаются исторически сложившиеся названия кислот. Лишь для сложно построенных кислот пользуются женевской номенклатурой:
 2-метилпентановая-1 кислота
2-метилпентановая-1 кислота
 4-этилгептановая-1 кислота
4-этилгептановая-1 кислота
Изомерия карбоновых кислот, как и в случае альдегидов, обусловлена изомерией углеводородных радикалов.
Карбоксильная группа сочетает в себе две функциональные группы - карбонил и гидроксил, взаимно влияющие друг на друга:
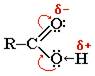
Кислотные свойства карбоновых кислот обусловлены смещением электронной плотности к карбонильному кислороду и вызванной этим дополнительной (по сравнению со спиртами) поляризации связи О–Н.
|
|
|
В водном растворе карбоновые кислоты диссоциируют на ионы:

Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей.
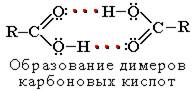
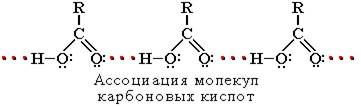
С увеличением молекулярной массы растворимость кислот в воде уменьшается.
Физические свойства.
Низшие представители предельных одноосновных кислот (до пропионовой кислоты включительно) представляют собой при обычных условиях весьма подвижные жидкости с резким запахом, смешивающиеся с водой в любых соотношениях. Легко перегоняются сами и с водяным паром. Следующие представители (начиная с масляной) – маслянистые жидкости с неприятным запахом, ограниченно растворимые в воде. Высшие кислоты – твердые вещества, нерастворимые в воде. Все кислоты жирного ряда растворимы в спирте и эфире.
Химические свойства.
Кислотные свойства. Если сравнить между собой формулы строения спиртов и карбоновых кислот
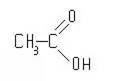
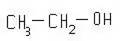
то может показаться, что вследствие наличия у спиртов и кислот одинаковой группы (гидроксильной) свойства их должны быть весьма сходны.
Спирты обладают настолько слабыми кислотными свойствами, что кислую реакцию спиртов не могут обнаружить даже самые чувствительные индикаторы. Кислотные свойства спиртов (как и воды) проявляются, например, в реакции со свободными щелочными металлами. Следовательно, кислотные свойства гидроксильного водорода в спиртах очень слабы.
В тоже время органические кислоты, аналогично неорганическим кислотам, обладают ярко выраженными кислотными свойствами. Водные растворы их окрашивают лакмус в красный цвет, что свидетельствует о диссоциации органических кислот на ионы:

Водород карбоксильной группы в отличие от водорода спиртового гидроксила замещается на металл не только при взаимодействии с металлами, но и при действии щелочей, с образованием солей карбоновых кислот: 
|
|
|
натриевая соль пропионовой к-ты
Таким образом, свойства гидроксильного водорода в спиртах заметно отличаются от его свойств в карбоновых кислотах.
Карбоновые кислоты обычно значительно слабее минеральных.
Восстановление кислот. При восстановлении кислот образуются соответствующий альдегид, который при дальнейшем восстановлении превращается в спирт:

Обычно восстанавливают на сами кислоты, а их хлорангидриды, ангидриды или сложные эфиры.
Также карбоновые кислоты взаимодействуют с:
1.Взаимодействие с металлами
2CH3COOH+Ca →(CH3COO)2Ca+H2
2.Взаимодействие с оксидами металлов
2CH3COOH+CaO → (CH3COO)2Ca+H2O
3.Реакция нейтрализации
2CH3COOH+Ca(OH)2 →(CH3COO)2Ca+2H2O
4.Взаимодействие с солями
2CH3COOH+CaCO3 → (CH3COO)2Ca+H2O+CO2
5.Действие галогенирующих агентов

6.Галогенирование кислот
CH3COOH+Br2 →CH2BrCOOH
Применение карбоновых кислот
Муравьиная кислота применяется в качестве восстановителя, в медицине-муравьиный спирт (1,25% спиртовой раствор муравьиной кислоты.
Уксусная кислота применяется для синтеза красителей, медицинских препаратов, сложных эфиров, при производстве ацетатных волокон. В домашнем хозяйстве-как вкусовое и консервирующее вещество.
Способы получения.
1. Окисление альдегидов и первичных спиртов — общий способ получения карбоновых кислот. В качестве окислителей применяются KМnО4 и K2Сr2О7. [O] [O]
R-CH2-OH → R-CH=O → R-CO-OH
спирт альдегид кислота
2. Получение карбоновых кислот из цианидов (нитрилов) — это важный способ, позволяющий наращивать углеродную цепь при получении исходного цианида. Дополнительный атом углерода вводят в состав молекулы, используя реакцию замещения галогена в молекуле галогенуглеводорода цианидом натрия, например:
СН3-Вr + NaCN → CH3 - CN + NaBr.
Образующийся нитрил уксусной кислоты (метилцианид) при нагревании легко гидролизуется с образованием ацетата аммония:
CH3CN + 2Н2О → CH3COONH4.
При подкислении раствора выделяется кислота:
CH3COONH4 + HCl → СН3СООН + NH4Cl.
3. Использование реактива Гриньяра по схеме:
CH3-MgBr + СО2 → CH3-COO-MgBr → CH3-COOH + Mg(OH)Br
4. Гидролиз сложных эфиров:
CH3-COO CH3 + КОН → CH3-COOK + CH3OH,
CH3-COOK + HCl → CH3-COOH + KCl
Уксусную кислоту получают каталитическим окислением бутана кислородом воздуха:
|
|
|
2С4Н10 + 5O2 → 4СН3СООН + 2Н2О
5. Для получения бензойной кислоты можно использовать окисление монозамешенных гомологов бензола кислым раствором перманганата калия:
5С6Н5-СН3 + 6KMnO4 + 9H2SO4 = 5С6Н5СООН + 3K2SO4 + 6MnSO4 + 14H2O.
53) Одноосновные непредельные кислоты - производные ненасыщенных углеводородов, у которых один атом водорода замещен карбоксильной группой.
А) В группе непредельных кислот наиболее часто используют эмпирические названия: СН2=СН-СООН - акриловая (пропеновая) кислота, СН2=С(СН3)-СООН - метакриловая (2-метилпропеновая) кислота
С17Н33СООН – олеиновая кислота (содержит в молекуле одну двойную связь), С17Н31СООН – линолевая кислота (в молекуле две двойные связи), С17Н29СООН – линоленовая кислота (в молекуле три двойные связи).
Б) Двухосновные предельные карбоновые кислоты (двухосновные насыщенные карбоновые кислоты) – карбоновые кислоты, в которых насыщенный углеводородный радикал соединен с двумя карбоксильными группами –COOH. Все они имеют общую формулу HOOC(CH2)nCOOH, где n = 0, 1, 2, …
С2Н2О4 – щавелевая кислота, С3Н4О4 – малоновая кислота
В) Ароматические карбоновые кислоты - в большинстве ароматических кислот содержится по крайней мере одно бензольное кольцо. Многие ароматические карбоновые кислоты имеют тривиальные названия: С6Н5СООН – бензойная кислота, СН3С6Н4СООН – орто-, мета- и пара-толуиловые кислоты, пара-НООС–С6Н4–СООН – терефталевая кислота. Все эти кислоты – кристаллические соединения, слабо растворимые в воде и хорошо – в спирте. Бензойная кислота содержится в некоторых природных смолах, входит в состав многих эфирных масел, найдена в ягодах брусники и клюквы, которые могут долго храниться, так как бензойная кислота – природный консервант. Бензойная кислота применяется также в производстве красителей и лекарственных веществ.
54) Уксусная кислота - СН3СООН.
Уксусная кислота представляет собой бесцветную жидкость с характерным резким запахом и кислым вкусом. Гигроскопична. Неограниченно растворима в воде. Смешивается со многими растворителями; в уксусной кислоте хорошо растворимы органические соединения и газы, такие как HF, HCl, HBr, HI и другие.
|
|
|
Химические свойства
Как и минеральные кислоты, уксусная кислота взаимодействует с металлами, основными оксидами, основаниями и солями:

Применение
Уксусная (метанкарбоновая, этановая) кислота СН3-СООН.
В обычных условиях (18-20ºС) представляет собой бесцветную жидкость с резким запахом, кипящую при 118,5ºС. При температуре ниже +16,6ºС (температура плавления уксусной кислоты) безводная уксусная кислота затвердевает в виде кристаллов, похожих на лед; вследствие этого безводная уксусная кислота получила название ледяной уксусной кислоты.
Уксусная кислота имеет большое народнохозяйственное значение. Она широко применяется в самых различных отраслях промышленности и в быту. В химической промышленности уксусная кислота используется для получения винилацетата, ацетата целлюлозы, красителей и многих других веществ. В виде солей она применяется в текстильной промышленности в качестве протравных веществ, служащих для закрепления красителя на волокне. В пищевой промышленности уксусная кислота используется для консервирования продуктов; некоторые сложные эфиры уксусной кислоты применяются в кондитерском производстве и т.д.
Уксусная кислота легко растворяется в воде. В быту применяют 3-5%-ный раствор уксусной кислоты, известный под названием уксус.
Получение
Уксусная кислота была известна еще в глубокой древности. Ее получали в виде уксуса из прокисшего виноградного вина. В настоящее время основным промышленным способом получения уксусной кислоты является ее синтез из ацетальдегида.
Реакция окисления ацетальдегида в уксусную кислоту протекает в несколько стадий. На первой стадии процесса происходит присоединение одной молекулы кислорода к молекуле ацетальдегида с образованием так называемой «надуксусной кислоты» (гидроперекиси ацетила):
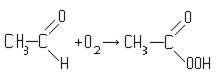
надуксусная кислота
Далее надуксусная кислота взаимодействует с еще одной молекулой ацетальдегида, и в результате образуются две молекулы уксусной кислоты:
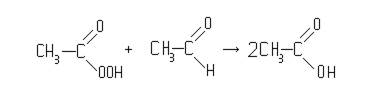
Надуксусная кислота очень нестойкое соединение, легко распадающееся на уксусную кислоту и кислород с выделением значительного количества тепла. Разложение больших количеств надуксусной кислоты может привести к взрыву. В связи с этим в процессе производства уксусной кислоты стремятся к тому, чтобы в системе не скапливалось большого количества надуксусной кислоты.
В промышленности процесс окисления ацетальдегида обычно проводят в жидкой среде (в среде уксусной кислоты) в присутствии катализатора – ацетата марганца. Наиболее удобным окислителем является кислород. Процесс проводится в колонне непрерывного действия, снабженной охлаждающими змеевиками. Ацетальдегид, содержащий растворенный катализатор, поступает вниз колонны, по высоте которой расположены четыре патрубка. Через патрубки поступает кислород. Процесс протекает при температуре 65-70ºС и давлении в нижней части колонны около 3 ат, а верхней части около 2 ат. Уксусная кислота из верхней части колонны поступает на ректификацию и очистку.
Для предупреждения взрыва надуксусной кислоты и образования взрывоопасных смесей кислорода с парами органических веществ в газовое пространство верхней части колонны непрерывно падает азот.
Перспективным методом получения уксусной кислоты является жидкофазное окисления бутана кислородом воздуха при 165-170ºС и давлении 50 ат:
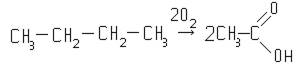
Реакция протекает по значительно более сложной схеме, чем это изображено выше, причем в этом процессе происходит образование целого ряда побочных продуктов.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 3435; Нарушение авторских прав?; Мы поможем в написании вашей работы!