
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Метод молекулярних орбіталей. В теорії ковалентного зв’язку залишались питання, які не можна було пояснити методом валентних зв’язків (ВЗ)
|
|
|
|
В теорії ковалентного зв’язку залишались питання, які не можна було пояснити методом валентних зв’язків (ВЗ). Як вже відомо, за методом ВЗ хімічний зв’язок здійснюється парою електронів. Але є випадки, коли в утворенні хімічного зв’язку бере участь один електрон, наприклад, в молекулярному йоні Н2+. Метод ВЗ не міг пояснити також ролі неспарених електронів в молекулах. Відомо, що молекули, які мають неспарені електрони, парамагнітні – втягуються в магнітне поле. До таких молекул належить молекула кисню. Вона парамагнітна і містить два електрони з паралельними спінами. Це протирічило методу ВЗ.
Для пояснення цих фактів і деяких інших був запропонований метод молекулярних орбіталей (МО), в розвиток якого великий вклад внесли Маллікен і Гунд.
Вихідне положення метода – всі електрони в молекулі є спільними і їх стан повинен описуватись не атомними орбіталями, а молекулярними, які охоплюють ядра всіх атомів, що входять до складу молекули.
Кожному електрону відповідає молекулярна орбіталь. Молекулярні орбіталі позначаються аналогічно атомним грецькими буквами: AO s p d f
МО σ π δ φ... (сігма, пі, дельта, фі).
Утворення МО можна представити як результат додавання і віднімання атомних орбіталей. Цей метод розрахунку називають методом лінійної комбінації атомних орбіталей і позначають ЛКАО – МО. При комбінації х атомних орбіталей утворюється х молекулярних орбіталей.
Перекривання двох атомних орбіталей призводить до утворення двох молекулярних, одна з яких має більш низьку, а друга більш високу енергію, ніж АО. Відповідно ці орбіталі називають зв’язуючими і розпушуючими. Утворення зв’язуючої і розпушуючої МО можна представити енергетичною схемою (рис.17).
|
|
|
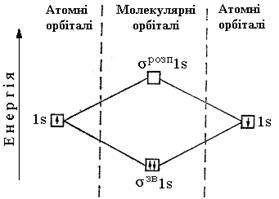
Рис. 17. Енергетична схема утворення молекулярних
орбіталей при взаємодії 1 s -орбіталей двох однакових атомів
Заповнення електронами молекулярних орбіталей відбувається так, як і атомних, тобто у відповідності з принципом мінімума (найменшої) енергії, принципом Паулі і правилом Гунда.
Кратність зв’язку визначається як піврізниця між числом електронів на зв’язуючих і на розпушуючих МО.
У відповідності з спектроскопічними дослідженнями молекулярні орбіталі двоатомних молекул по енергії розміщуються в такому порядку:
σЗВ1 s <σРОЗП1 s <σЗВ2 s <σРОЗП2 s <πЗВ2 pУ =πЗВ2 pZ <σЗВ2 pX <πРОЗП2 рУ =
=πРОЗП2 рZ <σРОЗП2 рX
Згідно з методом МО утворення молекул є можливим, якщо число електронів на зв’язуючих орбіталях більше за число електронів на розпушуючих орбіталях. Якщо число електронів на зв’язуючих і розпушуючих орбіталях однакове, то такі молекули утворитись не можуть.
Розглянемо, як метод МО пояснює утворення молекул Н2, О2 і неможливість існування молекули Не2.
Найстійкіший стан молекули досягається в тому випадку, коли електрони перебувають на молекулярних орбіталях, що відповідають мінімальній енергії. Тому при утворенні молекули водню обидва електрони перейдуть з атомних 1 s -орбіталей на зв’язуючу молекулярну орбіталь σЗВ1s (рис. 18).
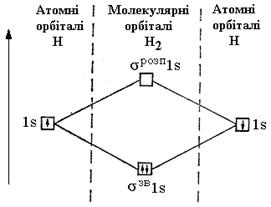
Рис. 18. Енергетична схема утворення молекули водню
Згідно з принципом Паулі ці електрони повинні мати протилежно напрямлені спіни.
Утворення молекули водню можна подати схемою:
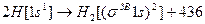 кДж.
кДж.
Число електронів – два на молекулярній σЗВ - орбіталі відображено верхнім індексом. В молекулі водню Н2 кратність зв’язку дорівнює (2-0):2 = 1, тобто Гідроген одновалентний.
Атом гелію містить два 1 s -електрони. При взаємодії двох таких атомів на МО повинні розміститись чотири електрони. Згідно з принципом Паулі на зв’язуючій орбіталі може розміститись тільки два електрони, два інших електрони повинні розміститись на розпорошуючій орбіталі. Кратність зв’язку дорівнює (2-2):2=0, хімічний зв’язок не виникає.
|
|
|
Розглянемо заповнення МО у кисню, молекула якого утворюється з атомів, що містять по два 1 s електрони, по два 2 s -електрони і по чотири 2 р -електрони. Електронна конфігурація атома 1 s 22 s 22 p 4. Атомні орбіталі першого енергетичного рівня утворюють МО (σЗВ 1 s)2 и (σРОЗП 1 s)2. Ці заповнені МО позначають буквою К.
s -Електрони другого енергетичного рівня перейдуть з АО на МО з утворенням однієї σЗВ і однієї σРОЗП орбіталей. р -Електрони другого енергетичного рівня перейдуть з трьох АО рХ, рУ і рZ на МО з утворенням однієї σЗВ МО, на якій розмістяться два електрони з АО рХ, утворенням двох πЗВ МО, на яких розміщуються чотири електрони з АО (рУ і рZ), і утворенням двох πРОЗП орбіталей, на яких згідно з правилом Гунда розміщується по одному електрону.
В молекулі з’являється два неспарених електрони, що зумовлює її парамагнітні властивості. Утворення хімічного зв’язку в молекулі кисню записується так:
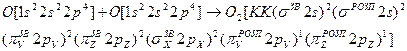
Кратність зв’зку дорівнює двом (6-2):2=2.
Отже, за допомогою методу молекулярних орбіталей можна пояснити властивості різних молекул. Метод МО не виключає метода ВЗ. Обидва методи доповнюють один одного.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 3429; Нарушение авторских прав?; Мы поможем в написании вашей работы!