
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Неполярний і полярний ковалентний зв’язок
|
|
|
|
Якщо двоатомна молекула складається з атомів одного елемента, наприклад, Н2, Сl2, N2, то кожна електронна хмара, яка утворена спільною парою електронів, розподіляється в просторі симетрично відносно ядер обох атомів. Такий ковалентний зв’язок називають неполярним.
Якщо двоатомна молекула складається з атомів різних елементів, то спільна електронна хмара зміщена в напрямку одного з атомів. В таких випадках ковалентний зв’язок називають полярним.
Для оцінки здатності атома даного елемента відтягати до себе спільну електронну пару користуються відносною електронегативністю. Чим більша електронегативність атома, тим сильніше притягає він спільну електронну пару.
Так, в молекулі гідроген хлориду (хлороводню) HCl спільна електронна пара зміщена в напрямку більш електронегативного атома хлору, що призводить до виникнення на атомі хлору ефективного негативного заряду:
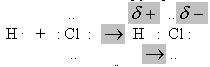
Тому HCl – полярна молекула. Її можна розглядати як систему з двох рівних за абсолютною величиною, але протилежних за знаком зарядів, розташованих на певній відстані один від одного. Такі системи називають диполями. Ступінь полярності визначають електричним моментом диполя (дипольним моментом) μ (мю), який дорівнює: μ = q . l, де μ - електричний момент диполя; q - абсолютне значення заряду електрона; l - відстань між центрами позитивного і негативного зарядів в молекулі.
Електричний момент диполя - це кількісна міра полярності молекули. В СІ одиниця електричного моменту диполя виража-ється величиною Кл.м (кулон-метр). Дипольні моменти можна також виражати в дебаях (D): 1D = 3,33 .10-30 Кл.м.
Отже, для двоатомних молекул типу АВ полярність зв’язку і полярність молекули співпадають. Із збільшенням різниці відносних електронегативностей елементів збільшуються електричні моменти диполів. Це можна простежити на ряді гідрогенгалогенідів HCl, HBr, HI. Електричні моменти диполів цих сполук дорівнюють відповідно 1.04, 0.79, 0.38 D, що пов’язано із зменшенням різниці електронегативностей атомів в ряді: HCl, HBr, HI.
|
|
|
Багатоатомні молекули можуть бути неполярними – при симет-ричному розподілі зарядів або полярними – при асиметричному.
Молекула типу АВ2 може бути полярною і неполярною. Електричний момент диполя кожного зв’язку можна розглядати як вектор. Тоді сумарний електричний момент диполя молекули можна вважати рівним векторній сумі дипольних моментів окремих зв’язків (рис. 7).


а) б)
Рис. 7. Дипольні моменти окремих зв’язків молекулах типу АВ2
різної будови:
а – лінійна будова; б – кутова будова;
жирною середньою стрілкою показано
вектор сумарного дипольного моменту молекули
У випадку (а) при лінійній будові молекули (наприклад, СО2) рівні за величиною електричні моменти диполів двох зв’язків АВ протилежні за напрямком. Дипольний момент такої молекули буде дорівнювати нулю. У випадку кутової будови (б) (наприклад, Н2О) векторна сума дипольних моментів двох зв’язків АВ відрізняється від нуля, вона виражається діагоналлю паралелограма. Така молекула є полярною. За величиною дипольних моментів можна зробити висновок про конфігурацію молекули.
Полярність молекул має вплив на властивості речовин, які вони утворюють. Речовини, утворені полярними молекулами, мають більш високі температури плавлення і кипіння, ніж речовини з неполярними молекулами.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 2007; Нарушение авторских прав?; Мы поможем в написании вашей работы!