
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способи утворення ковалентного зв’язку
|
|
|
|
Існують різні способи утворення ковалентного зв’язку.
1) За рахунок неспарених електронів в незбуджених атомах. Наприклад, це відбувається при утворенні таких молекул, як H2, HCl, Cl2, N2, NH3. Так, атоми Хлору в незбудженому стані мають один неспарений електрон, тому між ними утворюється один зв’язок; атом Нітрогену має три неспарених електрони, тому він може брати участь в утворенні трьох ковалентних зв’язків.

Валентність Хлору Валентність Нітрогену
дорівнює 1 дорівнює 3
2) За рахунок неспарених електронів в збудженому стані атома. Спарені електрони при збудженні можуть роз’єднуватись при наявності вільних орбіталей.
Так, Карбон в нормальному стані може утворити 2 зв’язки, а в збудженому – чотири. Його валентність дорівнює відповідно 2 і 4. Процес збудження можна подати схемою, у якій збуджений стан позначено зірочкою:
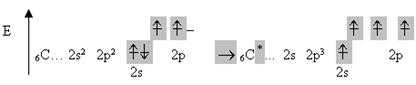
Елементи третього періоду мають d -підрівень, на який можуть переходити s - і р -електрони зовнішнього шару при збудженні.
Наприклад, атом Хлору, що має в незбудженому стані один неспарений електрон, може бути переведений, при затраті деякої енергії, у збуджені стани, що характеризуються наявністю трьох, п’яти, семи неспарених електронів:
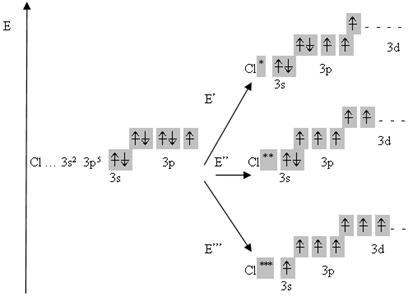
3) За рахунок неподіленої електронної пари одного атома і вакантної орбіталі іншого.
Отже, утворення ковалентного зв’язку може відбуватись при взаємодії одного атома або йона з заповненою атомною орбіталлю з іншим атомом або йоном, що має вакантну атомну орбіталь. Такий механізм утворення ковалентного зв’язку називається донорно-акцепторним.
Атом або йон, що дає пару електронів, називають донором, а атом або йон, який її приймає на вільну орбіталь, – акцептором.
|
|
|
Розглянемо утворення хімічного зв’язку за донорно-акцепторним механізмом при взаємодії молекули амоніаку з йоном Гідрогену NH3 + H+ →NH4+. Атом Нітрогену має на зовнішньому енергетичному рівні два спарених і три неспарених електрони.
В молекулі амоніаку неспарені 2 р -електрони атома Нітрогену утворюють три електронні пари з електронами атомів Гідрогену. У атома Нітрогену залишається неподілена пара електронів 2 s 2, тобто два електрони з антипаралельними спінами на одній атомній орбіталі.
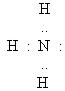
Атомна орбіталь йона Гідрогену не містить електронів (вакантна орбіталь). При зближенні молекули амоніаку і йона Гідрогену відбувається взаємодія неподіленої пари електронів атома Нітрогену і вакантної орбіталі йона Гідрогену. Неподілена пара електронів стає спільною для атомів Нітрогену і Гідрогену, виникає хімічний зв’язок за донорно-акцепторним механізмом. Атом Нітрогену молекули амоніаку є донором, а йон Гідрогену – акцептором. Утворення йона амонію можна представити такою схемою:
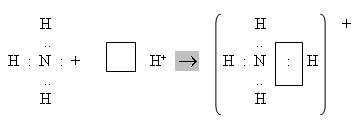
Атом Нітрогену в йоні NH4+ має валентність, що дорівнює чотирьом.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 2708; Нарушение авторских прав?; Мы поможем в написании вашей работы!