
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теоретична частина. Експериментальна частина
|
|
|
|
ЛАБОРАТОРНА РОБОТА № 8
Експериментальна частина
І. Визначення реакції середовища в розчинах солей
В чотири пробірки наливаємо 1/3 пробірки дистильованої води. В першу пробірку додаємо 5-6 крапель натрій ацетату, в другу – 5-6 крапель натрій карбонат, в третю – стільки ж ферум(ІІІ) хлориду, а в четверту – стільки ж калій хлориду. За допомогою універсального індикаторного паперу визначаємо рН розчинів солей. Записуємо рівняння гідролізу солей, які гідролізувались. Яка з солей не гідролізувалась? Які солі гідролізуються ступінчасто?
ІІ. Фактори, які посилюють ступінь гідролізу солей
а) В пробірку з розчином ферум(ІІІ) хлориду (з досліду 1) додати 5-6 крапель натрій гідроксиду, а в пробірку з натрій карбонатом – додати 5-6 крапель хлоридної кислоти. Записати спостереження та йонно-молекулярні рівняння повного гідролізу цих солей.
б) В пробірку налити 1/3 дистильованої води, додати 5-6 крапель ферум(ІІІ) хлориду та стільки ж натрій карбонату. Відмітити утворення осаду та виділення газу. Записати йонно-молекулярне рівняння спільного гідролізу цих солей.
в) В пробірку налити 1/3 дистильованої води, додати декілька кристалів натрій ацетату та 1-2 краплі фенолфталеїну. Відмітити забарвлення розчину. Нагріти пробірку з розчином солі до кипіння та відмітити зміну забарвлення індикатора. Записати йонно-молекулярне рівняння гідролізу цієї солі. Як вплине температура на ступінь гідролізу солі?
Контрольні завдання
Для наведених нижче солей (таблиця 16):
1) скласти рівняння гідролізу;
2) розрахувати константу К г та ступінь гідролізу h та рН розчину.
Таблиця 16
| № | Речовина | СМ, моль/л | № | Речовина | СМ, моль/л |
| NaNO2 | 0,1 | NH4NO3 | 0,01 | ||
| Na2S | 0,1 | Na2CO3 | 0,05 | ||
| K2CO3 | 0,01 | LiF | 0,1 | ||
| NH4F | 0,05 | (NH4)2CO3 | 0,01 | ||
| Na3PO4 | 0,5 | K2S | 0,05 | ||
| CH3COONa | 0,1 | NH4Cl | 0,5 | ||
| NaBO2 | 0,1 | KCN | 0,1 | ||
| KF | 0,01 | NaF | 0,1 | ||
| Na3BO3 | 0,05 | NH4I | 0,01 | ||
| K3PO4 | 0,1 | KNO2 | 0,05 |
|
|
|
ОКИСНО-ВІДНОВНІ РЕАКЦІЇ
Окисно - відновні реакції - це реакції, що супроводжуються зміною ступенів окиснення атомів, що входять до складу реагуючих речовин.
Окиснення – це процес віддавання електронів атомом, молекулою або іоном. Атоми, молекули або іони, що віддають електрони, називаються відновниками, самі ж вони окиснюються.
Відновлення – це процес приєднання електронів атомом, молекулою або іоном. Атоми, молекули або іони, що приєднують електрони, називаються окисниками, самі ж вони відновлюються.
Ступінь окиснення атома позначається арабською цифрою із знаком „+” або „– “ і ставиться над символом хімічного елемента.
Ступінь окиснення – це той електричний заряд, який виникає на атомі в результаті зміщення електронних пар від атома з меншою електронегативністю до атома з більшою електронегативністю.
Можна дати і інше визначення цього поняття: ступінь окиснення – це той умовний заряд атома в сполуці, який обчислений, виходячи з припущення, що речовина складається тільки з йонів.
В більшості сполук ступінь окиснення Оксигену дорівнює – 2 (винятки OF2, де ступінь окиснення Оксигену +2 і пероксиди Н2О2, Na2O2, де ступінь окиснення –1).
Для Гідрогену в сполуках характерний ступінь окиснення +1 (виняток – гідриди металів NaH, CaH2, де ступінь окиснення Гідрогену –1).
В молекулах простих речовин ступені окиснення атомів дорівнюють нулю.
Ступінь окиснення атомів в простих йонних сполуках за знаком і величиною дорівнює електричному заряду йону.
Наприклад, K+1Cl-1.
Якщо молекула утворюється за рахунок ковалентного зв’язку, то ступінь окиснення більш електронегативного атома має знак (-), а менш електронегативного (+). Наприклад, S+4O2-2.
|
|
|
Алгебраїчна сума ступенів окиснення атомів в сполуці дорівнює нулю, а в складному йоні – заряду йона. Виходячи з цього, можна легко визначити ступінь окиснення атомів в складних сполуках.
Класифікація окисно-відновних реакцій
Окисно-відновні реакції поділяються на три типи:
1) міжмолекулярного окиснення-відновлення;
2) внутрішньомолекулярного окиснення-відновлення;
3) диспропорціонування (самоокиснення – самовідновлення).
До першого типу належать реакції, при перебігу яких електрони переходять від молекул одних речовин до молекул інших, тобто окисник і відновник представлені різними речовинами:
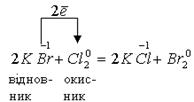
До другого типу належать реакції, які відбуваються із зміною ступенів окиснення різних атомів в одній молекулі. В цьому випадку атом, який має вищий ступінь окиснення, окиснює атом з нижчим ступенем окиснення:
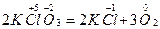 ;
;
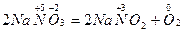 .
.
В реакціях третього типу вихідна речовина виявляє функції як окисника, так і відновника:
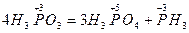 .
.
Фосфатна(ІІІ) кислота (ступінь окиснення Фосфору +3) виступає одночасно окисником (Фосфор відновлюється до ступеня окиснення –3 в сполуці РН3) і відновником (Фосфор окиснюється до ступеня окислення +5 в фосфатній кислоті Н3РО4).
Реакції такого типу можливі, якщо відповідний елемент знаходиться в вихідній сполуці в проміжному ступені окиснення. В розглянутому прикладі ступінь окиснення Фосфору в вихідній сполуці (+3) має проміжне значення між можливим максимальним (+5) і мінімальним (-3) ступенями окиснення цього елемента.
Правила складання рівнянь електронного балансу
При складанні рівнянь електронного балансу виходять з того, що:
а) сума електронів, які беруть участь в реакції відновлення, дорівнює сумі електронів, які беруть участь в реакції окиснення;
б) алгебраїчна сума ступенів окиснення окремих атомів, відповідних молекул, дорівнює нулю;
в) визначають речовини, в яких атоми змінюють свій ступінь окиснення;
г) занотовують рівняння електронного балансу, в яких розраховується кількість електронів, які віддає відновник і приймає окисник;
д) зрівнюють кількості приєднаних і відданих електронів введенням множників, виходячи з найменшого загального кратного для коефіцієнтів у процесах окиснення й відновлення;
|
|
|
е) знайдені коефіцієнти підставляють у рівняння реакції перед відповідними формулами речовин у лівій і правій частинах.
ж) підбирають коефіцієнти для решти учасників реакції.
Приклад. Методом електронного балансу розставте коефіцієнти в рівнянні окисно-відновної реакції:
Р + НСlО3 + Н2O = Н3РO4 + НС1.
На початку складання рівняння реакції визначаємо елементи, що змінили ступінь окиснення, і складімо електронний баланс процесів окиснення й відновлення:
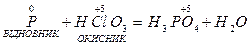
Ступінь окиснення змінюють Фосфор і Хлор. Складімо електронні рівняння:
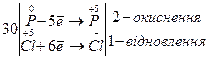
Найменше спільне кратне дорівнює 30.
Знайдені коефіцієнти підставляємо до рівняння реакції:
6Р + 5НСlО3 + Н2O → 6Н3РO4 + 5НСl.
Порівняння лівої і правої частин рівняння показує, що для повного матеріального балансу в лівій частині перед Н2O треба виставити коефіцієнт 9.
Тоді в остаточному вигляді має місце наступне рівняння:
6Р + 5НСlО3 + 9Н2O → 6Н3РO4 + 5НСl.
Еквівалент і молярна маса еквівалентів
окисника і відновника
В окисно-відновних реакціях еквівалент речовини – це та умовна частинка (частка структурної одиниці), яка приймає (окисник) або віддає (відновник) один електрон. Так, в кислому середовищі йон MnO4- приймає 5 електронів, тому fекв для KМnO4 дорівнює 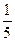 , а еквівалент калій перманганату -
, а еквівалент калій перманганату - 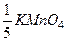 .
.
Молярна маса еквівалентів окисника дорівнює молярній масі окисника, поділеній на число приєднаних однією молекулою електронів.
Молярна маса еквівалентів відновника дорівнює молярній масі відновника, поділеній на число відданих однією молекулою електронів.
Визначимо еквіваленти і молярні маси еквівалентів окисника і відновника в такій окисно-відновній реакції:
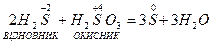
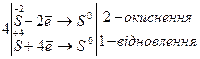
Йон S2- віддає 2 електрони, тому fЕКВ для Н2S дорівнює 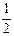 , а еквівалент
, а еквівалент 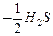 . Йон SO32- приймає 4 електрони, тому fЕКВ для H2SO3 дорівнює
. Йон SO32- приймає 4 електрони, тому fЕКВ для H2SO3 дорівнює 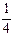 , а еквівалент -
, а еквівалент - 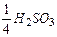 .
.
Молярна маса еквівалентів відновника H2S:
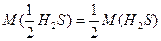 .
.
Молярна маса еквівалентів окисника H2SO3:
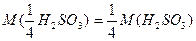 .
.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 859; Нарушение авторских прав?; Мы поможем в написании вашей работы!