
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теоретична частина. Електроліти– це речовини, розчини або розплави яких проводять електричний струм за рахунок дисоціації на йони
|
|
|
|
ЛАБОРАТОРНА РОБОТА №5
РЕАКЦІЇ В РОЗЧИНАХ ЕЛЕКТРОЛІТІВ
Електроліти – це речовини, розчини або розплави яких проводять електричний струм за рахунок дисоціації на йони.
Дисоціація – розпад молекул, йонів, радикалів на частинки з меншою масою.
Електроліти
| С И Л Ь Н І: 1. Розчинні у воді солі; 2. Кислоти: HNO3, HClO4, HCl, HBr, HJ, H2SO4 (за І ступенем дисоціації); 3. Гідроксиди лужних та лужно-земельних металів: LiOH, NaOH, KOH, Ca(OH)2, Ba(OH)2 (за І ступенем дисоціації) | С Л А Б К І: 1. Малорозчинні у воді солі; 2. Більшість органічних кислот(СН3СООН); 3. H2CO3, H2SiO3, H2S, HCN, H3BO3, H2SO3; 4. NH4OHта малорозчинні у воді гідроксиди металів: Cu(OH)2, Fe(OH)3, Al(OH)3, Mg(OH)2, Pb(OH)2, Cr(OH)3 |
Речовини, які практично повністю дисоціюють на йони в розчинах, називаються сильними електролітами.
Електроліти, які частково дисоціюють або є нерозчинними, називаються слабкими електролітами.
Кількісною характеристикою електролітичної дисоціації є ступінь дисоціації (α), який дорівнює відношенню числа дисоційованих молекул до загального числа молекул електроліту в розчині:
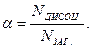
Процес дисоціації багатоосновних кислот та багатокислотних основ відбувається ступінчасто. Наприклад, дисоціація сульфітної кислоти відбувається таким чином:
І ступінь: 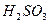 L
L 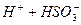 ;
;
ІІ ступінь: 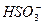 L
L 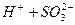 .
.
Константа рівноваги слабкого електроліту К називається константою дисоціації КДИС. Вона як і ступінь дисоціації є кількісною мірою здатності електроліту дисоціювати у розчині. Для розчину сульфітної кислоти, яка дисоціює за І ступенем, константа дисоціації має вираз:
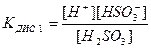 ; К1 = 4,5 . 10-7,
; К1 = 4,5 . 10-7,
а за ІІ ступенем:
 ; К2 = 4,8 . 10-7.
; К2 = 4,8 . 10-7.
Чим менше значення КДИС., тим електроліт є слабкішим. Між константою дисоціації та ступенем дисоціації є зв’язок, відомий під назвою закону розбавлення Оствальда:
|
|
|
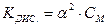 , звідки
, звідки 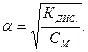
Реакції обміну в розчинах електролітів відбуваються в напрямку утворення слабких електролітів, виділення газу і утворення осаду.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 452; Нарушение авторских прав?; Мы поможем в написании вашей работы!