
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теоретична частина. Концентрація – це найважливіша характеристика будь-якого розчину
|
|
|
|
ЛАБОРАТОРНА РОБОТА № 4
ПРИГОТУВАННЯ РОЗЧИНУ ХЛОРИДНОЇ КИСЛОТИ ТА ВИЗНАЧЕННЯ ЇЇ КОНЦЕНТРАЦІЇ ТИТРУВАННЯМ
Концентрація – це найважливіша характеристика будь-якого розчину. Вона визначає вміст речовини в одиниці маси або об'єму розчину (іноді розчинника).
ІЮПАК рекомендує використовувати кілька способів вираження кількісного складу розчинів, які ґрунтуються на сталості маси розчину, розчиненої речовини, розчинника чи об'єму розчину.
Способи вираження кількісного складу розчинів
1. Масова частка речовини в розчині – ω(X) – це відношення маси розчиненої речовини m(Х), що міститься в розчині, до загальної маси цього розчину mРОЗЧ.:
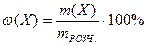 або
або 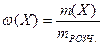 ,
,
де Х – розчинена речовина; m(X) – маса речовини, г; mРОЗЧ. – маса розчину, г.
Одиниця вимірювання відносна. Допускається виражати масову частку речовини у частках одиниці або відсотках. ω(X) в % називається також відсотковою концентрацією й дорівнює масі речовини в 100 г розчину.
2. Молярна частка розчиненої речовини X у розчині — це відношення кількості речовини X (в молях), що міститься у цьому розчині, до загальної кількості речовин у розчині (в молях):
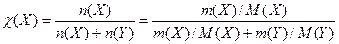 ,
,
де χ (X)- молярна частка розчиненої речовини Х; n(X) – кількість моль розчиненої речовини Х; n(Y) – кількість моль розчинника Y; m(X) – маса речовини, М(X) – молярна маса речовини, г/моль; m(Y) – маса розчинника, М(Y) – молярна маса розчинника, г/моль.
Одиниця вимірювання відносна. Допускається виражати молярну частку в таких же одиницях, як і масову частку розчиненої речовини у розчині.
3. Молярна концентрація речовини X у розчині — це відношення кількості речовини n(X), що міститься у розчині, до об'єму (VРОЗЧ.) цього розчину.
Молярна концентрація речовини показує скільки моль розчиненої речовини міститься в 1 дм3 розчину.
|
|
|
В СІ основною одиницею молярної концентрації є моль/м3, а для практичного користування — моль/дм3 або моль/л:
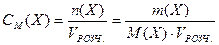 ,
,
де Х – розчинена речовина; n(Х) – кількість речовини, моль; m(X) – маса речовини, М(X) – молярна маса речовини, г/моль; VРОЗЧ. – об'єм розчину, л.
Розчин з молярною концентрацією розчиненої речовини, яка дорівнює:
1моль/дм3, називається одномолярним розчином (1М розчин);
0,1 моль/дм3 називається децимолярним розчином (0,1М розчин);
0,01 моль/дм3, називається сантимолярним (0,01М розчин);
0,001 моль/дм3 називається мілімолярним (0,001М розчин).
Для розчинів і газів дозволяється також позначення молярної концентрації речовини за допомогою квадратних дужок, в яких записується формула відповідної речовини.
Наприклад, [О2] = 0,01 моль/дм3.
4. Молярна концентрація еквівалентів у розчині або нормальна концентрація (застаріла назва „еквівалентна” концентрація) — це відношення кількості моль еквівалентів (nЕ(Х)) у розчині до об'єму цього розчину (VРОЗЧ.):
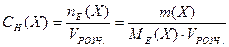 ,
,
де Х – розчинена речовина; nЕ(Х) – кількість речовини еквівалента, моль; m(X) – маса речовини, МЕ(X) – молярна маса еквівалентів речовини, г/моль; VРОЗЧ . – об'єм розчину, л.
Одиниця вимірювання молярної концентрації еквівалентів є моль/м3, а для практичного користування — моль/дм3 або моль/л.
За рекомендаціями ІЮПАК, якщо 1 моль речовини еквівалентів розчинено в 1дм3 розчину, то саме цей розчин можна назвати нормальним розчином.
Розчин концентрацією речовини СН(Х) = 1моль/дм3 називається однонормальним розчином речовини X, тобто розчин, що містить 1 моль-еквівалент речовини в 1дм3;
з СН(Х) = 0,1моль/дм3 - децинормальним розчином;
з СН(Х) = 0,01 моль/дм3 — сантинормальним розчином;
з СН(Х) = 0,001 моль/дм3 — мілінормальним розчином речовини X.
Замість позначення одиниці вимірювання кількості речовини еквівалентів моль/дм3 допускається скорочення н. або N.
|
|
|
Між молярною концентрацією речовини X у розчині і нормальною концентрацією речовини X у розчині є зв'язок:
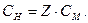
Наприклад: 1М розчин Н2SO4 відповідає 2н. розчину Н2SO4 (Z= 2); 0,06 М розчин Н2SO4 відповідає 0,12 н. розчину Н2SO4 (Z= 2); 0,1 н. розчин KMnO4 (KMnO4 = 5) відповідає 0,02М розчину KMnO4.
5. Моляльність розчиненої речовини в розчині (застаріла назва „моляльна концентрація” розчиненої речовини) – це відношення кількості речовини n(X) (в молях), що міститься у розчині, до маси m розчинника Y (в кг) цього розчину:
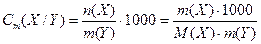 .
.
Одиниця вимірювання моль/кг.
6. Титр розчину – це маса речовини Х, яка міститься в одному см3 розчину:
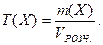
Одиниці вимірювання: кг/см3, для практичного користування г/см3, г/мл (остання – несистемна).
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 508; Нарушение авторских прав?; Мы поможем в написании вашей работы!