
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
А. Кривая титрования сильной кислоты (НС1) сильным основанием
|
|
|
|
Кривые титрования
Для того чтобы иметь возможность выбрать индикатор для титрования, кроме качественных показателей, необходимо использовать методы, дающие количественную характеристику этого процесса. К таким методам относятся метод построения «кривых титрования», метод вычисления индикаторной ошибки, совершаемой при титровании.
Метод «кривых титрования». При прибавлении к 0,1 н. раствору кислоты раствора щелочи такой же нормальности происходит изменение реакции среды из кислой в нейтральную, а затем в щелочную. Количество прилитого раствора щелочи будет соответствовать определенной величине рН и цвету индикатора.
Чтобы иметь возможность точно изучить этот процесс и выбрать нужный индикатор, используют графический метод. Для этого на оси ординат откладывают величину рН, а на оси абсцисс - количество раствора NaOH (в мл). При этом образуется кривая, которая будет характеризовать изменение рН в зависимости от количества миллилитров прилитого рабочего раствора. Различают три случая: А, Б и В.
Для построения кривой в коническую колбу наливают 20 мл 0,1 н. раствора соляной кислоты и из бюретки добавляют постепенно 20 мл 0,1 н. раствора гидроксида натрия. Рассчитывают величины рН, получающиеся в зависимости от прилитого количества миллилитров гидроксида, и по точкам строят кривую. Сначала находят начальную (исходную) точку кривой chci = 0,1 н. = 0,1 М, поэтому концентрация [Н+] = 0,1= 10-1 г-ион/л и рН = 1, поскольку степень диссоциации соляной кислоты при с = 0,1 н. будет равна 1. VNaOH = 0, начальная точка кривой будет иметь координаты: х 1 = 0, y1 = 1. Затем определяют конечную точку кривой (точку эквивалентности). Концентрация растворов равна 0,1 н., поэтому на 20 мл соляной кислоты будет израсходовано 20 мл раствора гидроксида натрия и [H+] = [OH-] = 10-7, а рН = 7.
|
|
|
В растворе будет находиться соль — хлорид натрия, которая не будет подвергаться гидролизу, и координаты точки эквивалентности будут х n = 20, рН = 7 (точка «2»), Зная координаты начальной и конечной точек, приступают к расчету промежуточных точек. Допустим, что в точке 3 к 20 мл 0,1 н. раствора соляной кислоты прибавили 18,00 мл 0,1 н. раствора гидроксида натрия NaOH, тогда в растворе осталось 2 мл 0,1 н, раствора соляной кислоты, т. е. в 10 раз меньше, и поэтому С 3 = 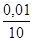 и рН = -lg [Н+] = -lg (10-2) = 2. В точке 4 прилили 19,80 мл NaOH, поэтому c hci = 0,001 М, [Н+] = 10-3 и рН = 3.
и рН = -lg [Н+] = -lg (10-2) = 2. В точке 4 прилили 19,80 мл NaOH, поэтому c hci = 0,001 М, [Н+] = 10-3 и рН = 3.
Таким же способом рассчитывают и другие промежуточные точки. По данным таблицы 10.1 строим кривую титрования сильной кислоты сильным гидроксидом.
Таблица 10.1 Изменение рН при титровании 20 мл 0,1 н. раствора соляной кислоты раствором гидроксида натрия
| Прибавление NaOH | Остаток НС1 | рН | ||
| % | мл | % | г-экв/л | |
| 99,9 100,0 100,1 | 19,8 19,98 20,00 20,02 20,2 | 1,0 0.1 0,1 1,0 10,0 | 0,1 0,01 0,001 0,0001 10-7 Избыток 0,0001 0,001 0,01 0,1 |
По кривой титрования видно, что к концу этого титрования происходит сильное изменение величины рН раствора и наблюдается резкий скачок. Если за время нейтрализации 99,9% кислоты рН изменяется постепенно от 1,0 до 4,0, то при добавлении весьма небольшого количества раствора гидроксида натрия (0,1 % до точки нейтрализации и 0,1% избыточных) рН повышается с 4,0 до 10,0. Последняя капля добавленной щелочи вызывает изменение рН на 6 единиц, а [Н+] в 1 000 000 раз, поэтому кривая на этом отрезке занимает вертикальное положение — этот вертикальный участок кривой называют скачком рН на кривой титрования, Если после достижения точки эквивалентности продолжать добавлять раствор гидроксида NaOH, то [Н+] будет уменьшаться и кривая во второй половине будет такой же пологой, как и в первой.
|
|
|
Кривая титрования сильной кислоты сильной щелочью (рис 10.1) характеризуется такими особенностями:
а) точка эквивалентности лежит на линии нейтральности:
б) скачок рН на кривой титрования (при 0,1 н, растворах) имеет большой интервал - от рН = 4,0 до рН = 10;
в) при титровании раствора щелочи кислотой начальная точка располагалась бы при рН = 13 - в нижней области графика.
На основании кривой титрования (для 0,1 н. растворов НС1 и NaOH) можно сделать вывод, что в этом случае применимы следующие индикаторы: метиловый оранжевый, метиловый красный, нейтральный красный и фенолфталеин, т. е. такие индикаторы, показатели титрования — рН которых находятся в области скачка рН на кривой.

рис 10.1 Кривая титрования сильной кислоты сильным основанием.
Для того чтобы не усложнять расчеты, увеличение объема раствора при титровании не учитывают.
|
|
|
|
|
Дата добавления: 2015-06-30; Просмотров: 3053; Нарушение авторских прав?; Мы поможем в написании вашей работы!