
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Интервал перехода индикаторов, показатель индикатора рК, показатель титрования рТ
|
|
|
|
Изменение окраски раствора индикатора при титровании связано с увеличением или уменьшением концентрации ионов Н+ и ОН-, а следовательно, переход цвета полностью зависит от величины рН титруемого раствора.
Так, если к раствору гидроксида (NaOH, КОН) добавить 2—3 капли индикатора метилового оранжевого, то жидкость окрасится в желтый цвет. При добавлении к этому раствору кислоты рН его будет уменьшаться, и, как показывает опыт, при рН = 3,1 окраска будет интенсивно розовой. Наоборот, если к розовому раствору прибавлять раствор щелочи (гидроксида NaOH, КОН), то при рН = 4,4 титруемый образец снова приобретает желтый цвет.
На основании этого опыта можно отметить, что конец реакции нейтрализации лежит неточно в точке эквивалентности, а в интервале рН = 3,1 до 4,4. При проведении этой же реакции насыщения в присутствии такого индикатора, как фенолфталеин, зона перехода будет находиться между рН = 8,0-10,0, После того как величина рН достигнет 10, изменения окраски уже не будет, сколько бы гидроксида натрия ни добавлялось. Следовательно, интервал между двумя значениями рН, в котором будет происходить постепенное изменение цвета индикатора, и будет являться зоной перехода, или интервалом (перехода окраски индикатора). К этому определению интервала действия индикатора можно прийти и другим путем.
Если последний опыт рассмотреть с точки зрения ионно-хромофорной теории, то для фенолфталеина будут иметь место два равновесных состояния:
равновесие перехода одной таутомерной формы в другую, в данном случае бензольной в хиноидную:
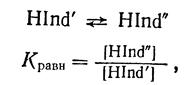
где Кравн — константа равновесия.
В свою очередь Hind" будет за счет диссоциации давать уже другое уравнение равновесия.
Hind" ↔ Н+ + Ind-, тогда:
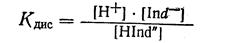
Перемножив почленно уравнения 1-е и 2-е и сократив на общий множитель Hind", получим:
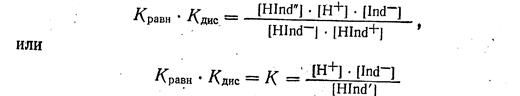
Поскольку К или (Кравн · Кдис) — кажущаяся степень ионизации индикатора, a [Ind-] - концентрация щелочной формы Сщ.ф; [Hind' ] - концентрация кислотной формы С к.ф. мы можем написать:

где рК будет являться показателем индикатора.
Основное уравнение ионно-хромофорной теории индикаторов показывает также, что изменение величины рН связано со значением дроби:
| С к.ф |
| С щ.ф |
которая показывает соотношение между кислотной и щелочной формами индикатора.
Не всякое добавление раствора щелочи или кислоты к раствору анализируемого вещества будет вызывать заметное изменение окраски, хотя величина рН и будет увеличиваться или уменьшаться. Возможность глаза воспринимать изменение цвета раствора весьма ограничена, поэтому только при довольно значительном изменении соотношения между кислотной и щелочной формами мы замечаем перемену окраски раствора. Чаще всего это изменение цвета делается заметным, если выражение
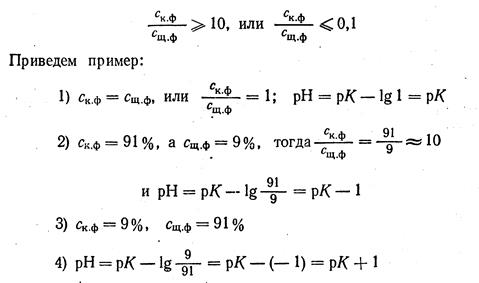
На основании этих данных можно прийти к выводу, что интервал перехода индикатора колеблется от рK + 1 до рК- 1, т.е. рН»рК ± 1. Для примера с фенолфталеином эта формула дает полное совпадение, так как интервал перехода его находится от 8-10.
В процессе титрования добавление рабочего раствора проводят до четкого изменения окраски раствора, которое можно наблюдать визуально. Если, например, титруют сильной кислотой раствор сильной щелочи, то в присутствии метилового оранжевого окраска продолжительное время будет оставаться желтой, хотя величина рН будет постепенно уменьшаться. Окраска станет желто-оранжевой тогда, когда рН титруемого раствора достигнет 4,4; четко оранжевой она станет при рН, равном 4,0.
Величину рН, при которой заканчивают титрование с данным индикатором, обозначают через рТ и называют показателем титрования. Значение рТ для некоторых индикаторов:
метиловый оранжевый = 4,0 лакмус = 7,0
метиловый красный = 5,5 фенолфталеин = 9,0.
|
|
|
|
|
Дата добавления: 2015-06-30; Просмотров: 6671; Нарушение авторских прав?; Мы поможем в написании вашей работы!