
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения типовых задач. Задача 1. Написать молекулярные и ионно-молекулярные уравнения гидролиза сульфита калия K2SO3
|
|
|
|
Задача 1. Написать молекулярные и ионно-молекулярные уравнения гидролиза сульфита калия K2SO3. Каков механизм гидролиза? Какая среда водного раствора?
Решение: Соль образована катионом сильного основания и анионом слабой двухосновной кислоты. Гидролиз идет по аниону.
Молекулярные уравнения гидролиза:
1 ступень: К2SО3 + H2O  KHSO3 + КОН
KHSO3 + КОН
2 ступень: KHSO3 + Н2O  Н2SО3 + КОН
Н2SО3 + КОН
Ионно-молекулярные уравнения гидролиза:
1 ступень: SO32- + Н2О  HSO3- + OH-
HSO3- + OH-
2 ступень: HSO3- + Н2O  Н2SО3 + ОН-
Н2SО3 + ОН-
В растворе щелочная реакция среды, так как в результате гидролиза образуется сильное основание (щелочь КОН).
Задача 2. Написать молекулярные и ионно-молекулярные уравнения гидролиза нитрата свинца (II). Каков механизм гидролиза? Какая среда водного раствора?
Решение: Соль образована катионом слабого двухкислотного основания и анионом сильной кислоты. Гидролиз идет по катиону.
Молекулярные уравнения гидролиза:
1 ступень: Pb(NO3)2 + Н2О  (PbOH)NO3 + HNO3
(PbOH)NO3 + HNO3
2 ступень: (РbОН)NО3 + Н2О  Pb(OH)2 + НNО3
Pb(OH)2 + НNО3
Ионно-молекулярные уравнения гидролиза:
1 ступень: Рb2+ + Н2О  РbОН- + Н+
РbОН- + Н+
2 ступень: РbОН- + Н2О  Pb(OH)2 + Н+
Pb(OH)2 + Н+
Раствор имеет кислую реакцию среды, так как в результате реакции гидролиза образуется сильная кислота HNO3.
Пример 3. Написать уравнение гидролиза цианида аммония NH4OH. Какова реакция среды в водном растворе этой соли?
Решение: Соль образована катионом слабого основания и анионом слабой кислоты, поэтому гидролиз идет как по катиону, так и по аниону:
NH4CN + Н2О  NH4OH + HCN
NH4OH + HCN
NH4+ + CN- + Н2О  NH4OH + HCN.
NH4OH + HCN.
Для оценки реакции среды необходимо сравнить константы диссоциации NH4OH и HCN (см. таблицу 1). Так как константа диссоциации гидроксида аммония больше, чем константа диссоциации синильной кислоты, то гидроксид аммония является более сильным электролитом (основанием). В растворе будут преобладать ионы ОН-, следовательно, реакция среды щелочная.
|
|
|
Задача 4. Учитывая только первую ступень гидролиза 0,5М раствора Na2S, рассчитайте константу гидролиза, степень гидролиза и рН среды.
Решение: Гидролизу по первой ступени соответствует следующее ионно-молекулярное уравнение:
S2- + Н2О  НS- + OH-
НS- + OH-
Константа гидролиза Na2S по первой ступени есть отношение ионного произведения воды к константе диссоциации слабой кислоты HS-.
Кг = Косн /К(HS-)
Здесь в качестве К(HS-) необходимо применять константа диссоциации гидросульфид – иона, то есть К2(H2S), так как в реакции гидролиза участвуют сульфид анион (левая сторона) и гидросульфид анион (правая сторона). Химическое равновесие между этими анионами выражается второй ступенью диссоциации сероводородной кислоты:
НS-  S2- + Н+ (К2= 4
S2- + Н+ (К2= 4  )
)
Кг = 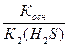 = 10-14/4
= 10-14/4  10-14 = 0,25
10-14 = 0,25
Степень гидролиза (h) можно рассчитать по формуле:
H = 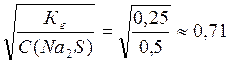
Для нахождения рН среды рассчитаем концентрацию водородных ионов:
[H+] = Kосн/С(Na2S)  h = 10-14/0,5
h = 10-14/0,5  0.71 = 2.82
0.71 = 2.82  10-14 (моль/л).
10-14 (моль/л).
pH = -lg[H+] = -lg (2.82  10-14) = 13,55
10-14) = 13,55
Ответ: Кг = 0,25; h = 0,71; pH = 13,55
Задача 5. рН 0,5 М раствора калиевой соли некоторой кислоты равен 12. Вычислить константу диссоциации той кислоты.
Решение: Так как рН водного раствора соли, образованной сильным основанием (КОН) и неизвестной кислотой больше 7, то эта соль гидролизуется по аниону, то есть является солью, образованной сильным основанием слабой кислотой.
Концентрация протона в растворах таких солей определяется формулой (см. таблицу 2): 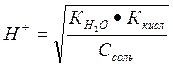 .
.
Если рН=12, то [Н+] = 10-12 моль/л. Возведем в квадрат обе стороны уравнения. Тогда [Н+]2 =  ; 10-24 =
; 10-24 =  .
.
Ккисл =  = 5
= 5 
Ответ: Ккисл = 5*10-11
Варианты задач по теме 3.1.2. гидролиз солей
1. Какие из перечисленных ниже солей будут подвергаться гидролизу? Написать соответствующие молекулярные и ионно-молекулярные уравнения. Рассчитать для 0,2М растворов константу гидролиза, степень гидролиза и рН среды, учитывая только первую ступень гидролиза: K2SO4; NaClO4; Na2S; CuSO4; КNО3; Рb(N03)2; (NН4)2СО3; КNO3.
|
|
|
2. При сливании растворов Al2(SO4)3 и Na2S выпадает белый осадок и ощущается неприятный запах. Объясните причину этого, приведя соответствующие уравнения реакций. Почему раствор NаН2РO4, имеет слабокислую, а раствор Nа3РO4 щелочную реакцию? Ответ мотивировать соответствующими уравнениями реакций и расчетами.
3. Какие из приведенных ниже солей гидролизуются? Для гидролизующихся солей написать ионные и молекулярные уравнения гидролиза и указать реакцию раствора: NH4NO3, ВеСl2, К2S04, NаNО2, Nа2СО3, ВаС12, Al2(SO4)3, NазР04, FеS04, (NH4)2S, Са(СН3СОО)2.
4. Напишите ионные и молекулярные уравнения гидролиза солей и укажите качественно значение рН растворов: K2SO3, СгС13, СuSO4, K2S, К3РO4, Fе(NO3)3.
5. Что произойдет при нагревании и разбавлении растворов? Напишите уравнения реакций.
6. Вычислите константу гидролиза, степень гидролиза и рН растворов солей: а) 0,5М NH4NО3, б) 0,1М KNO2, в) 0,1М Nа2S, г) 0,3М FеС13, д) 0,5М СН3СООNН4.
7. Рассчитайте Кг и рН 1М растворов NаН2РO4, Nа2НРO4 и Nа3РO4. Какая из солей гидролизуется в наибольшей степени и почему? Сравнивая величины Кг и соответствующие Кк-ты, объясните, почему в растворе.NаН2P04 среда кислая, а в растворе Nа2НР04 - щелочная.
8. Напишите ионные и молекулярные уравнения реакций, происходящих при сливании растворов: а) А1(NО3)3 и (NH4)2S, б) Fe2(SO4)3 и Nа2СО3, г) СгС13 и К2SO3. Объясните смещение равновесия гидролиза и практически необратимое его протекание.
9. Вычислить степень гидролиза Na3PO4 по первой ступени в 0,1М растворе. Какое значение рН этого раствора?
10. Вычислить константу, степень гидролиза и рН 0,1 М раствора сульфита натрия.
11. Почему раствор NaHCO3 имеет слабощелочную, а раствор NaHSO3 слабокислую?
12. Вычислить степень гидролиза 0,1 М раствора NaHS. Какое значение рН имеет этот раствор?
13. Какой рН имеют растворы NaHCO3 и NaHSO3? Объясните причину таких результатов.
14. рН О,1 М раствора натриевой соли некоторой органической кислоты равен 10. Вычислить константу диссоциации этой кислоты.
15. Вычислить константу, степень гидролиза и рН 0,2 М раствора Na2CO3 и 0,01M NaHCO3.
16. Вычислить константу и степень гидролиза и рН 0,1 М раствора ортофосфата натрия.
17. Вычислить рН, константу и степень гидролиза 0,1 М раствора Na2CO3.
|
|
|
18. Вычислить степень гидролиза ортофосфата натрия по первой ступени в 0,1 М растворе. Какое значение рН раствора?
19. Почему раствор гидрокарбоната натрия имеет слабощелочную, а раствор гидросульфита-слабокислую реакцию?
20. Вычислить степень гидролиза 0,1М раствора гидросульфида натрия. Какое значение рН имеет этот раствор?
21. рН 0,1 М раствора натриевой соли некоторой кислоты равен 10. Вычислить константу диссоциации этой кислоты.
22. Вычислить константу, степень гидролиза и рН растворов 0,2М Nа2CO3 и 0,01М NaНСО3.
23. Вычислить константу и степень гидролиза 1,0 М ортофосфата натрия. Каков рН этого раствора дигидроортофосфата натрия.
24. Вычислить константу гидролиза хлорида аммония, определить степень гидролиза этой соли в 0,01М растворе и рН раствора.
25. 27.Раствор дигидроортофосфата натрия имеет слабокислую, а ортофосфата натрия - сильнощелочную. Объяснить эти факты и мотивировать их соответствующими ионно-молекулярными уравнениями.
26. При сливании водных растворов Сr(NО3)3 и Na2S образуется осадок гидроксида хрома (III) и выделяется газ. Составьте молекулярное и ионно-молекулярное уравнение происходящей реакции.
27. Сравнить степень гидролиза соли и рН среды в 0,1 М и 0,001 М растворах цианида калия. Сделайте вывод о зависимости указанных параметров от концентрации.
28. Вычислить степень гидролиза ортофосфата натрия по первой ступени в 0,1 М растворе. Какое значение рН раствора?
29. Вычислить степень гидролиза 0,1М раствора гидросульфида натрия. Какое значение рН имеет этот раствор?
30. Вычислить константу, степень гидролиза и рН растворов 0,2М Nа2CO3 и 0,01М NaНСО3.
31. Вычислить константу рН и степень гидролиза 1,0 М ортофосфата натрия.
32. Вычислить константу гидролиза хлорида аммония, определить степень гидролиза этой соли в 0,01М растворе и рН раствора.
33. Сравнить степень гидролиза соли и рН среды в 0,1М и 0,001М растворах цианида калия. Сделайте вывод о зависимости указанных параметров от концентрации.
|
|
|
|
|
Дата добавления: 2015-06-29; Просмотров: 11060; Нарушение авторских прав?; Мы поможем в написании вашей работы!