
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Байланыс энергиясы. 3 страница
|
|
|
|
Көрсетілген оралымды 1.21 – суреттегідей тұрғызу үшін шардағы жазықтық қабаты сол торда көрсетілген.
Гексагональды оралым жағдайында сыртқы А қабатын екінші қабатпен осы қабаттағы тор түйіндерінің проекциясы В позициясы орын басады, позициясын басатындай етіп орналастырамыз. Қабаттарды осылай ораналастыруды жалғастыра отырып, қабат АВАВАВАВ немесе АСАСАСАС тізбегімен жүретіндей оралымға келеміз. NaCl тұзды тастың структурасы. NaCl структурасында күрделі размерлі СІ анионы кубтық тығыз оралымда болады, яғни бос октаэдрикалықтар Na катиондармен салынған. Барлық бос тетраэдрикалық тығыздықтар толтырылған емес. NaCl торды әрбір иондар тек бір белгіні құрайтын екі шектік центрлі структура жиынтығы ретінде қарастыруға болады.
NaCl ұяшық параметрі a=0.282 тең. Кез келген структуралардың маңызды сипаттарының бірі болып координациондық шар болып табылады. NaCl z=6 структурасында хлордың әрбір атомы Na алты ионмен қоршалған, ал Na әрбір ион Cl алты ионмен қоршалған.
Табиғатта ZnS екі модификацияда кездесседі: 1) қарапайым цинктік алдау немесе сфалерит, S анионды кубтық оралымдары бар бір жартылай тетраэдрикалық бос Zn катиондармен толтырылған. Цинктік алдам структурасы төрт үш осьпен сәйкес төрт полярлы ось бар.
2) гексагональды ZnS модификация – S аниондар оралымындағы гексагональды негізде болады.
Алмаз структурасы (1.28 - сурет). Алмаз структурасы типі бойынша Sl және Ge жартылай проводниктері кристалданады. Алмаз структурасы төрт тең санды координационды структурасының тығыз оралмағаны мысал бола алады. Углеродтың әрбір атомы басқа төрт атомымен тетраэдрикалық қоршалған. Алмаз структурасы цинктік алдау структурасына идентивті дейді. Егер оған Zn және S атомдары углерод атомдарын басса. Н.В. Белов тығыз оралған рамкадағы алмаз структурасын бейнелеуді жалғастырады. Ол үшін мынадай ұйғарым болды: структура радиусы 0,015 және 0,15 тең углерод атомдарының екі сортынан құралған C4+ мен С4- углерод атомдары екі сорттан құралған.
|
|
|
Металдар. Металдардың сандар мен металдық фаза структурасын тығыз оралым көмегімен бейнелеуге болады.Металдық фазада тығыз оралымды металдар атомы бар.
Металдардың үлкен саны кубтық тығыз оралым типі арқылы кристалданады: Ag, Al, Au, Ca, Cu, y-Fe, Ni, Pb және т.б. бұл металдардың барлығы кубтық шектік орталықтанған болып табылады.
Сипатты болып табылады егер, бірде бір металл қарапайым кубтық тип немесе қарапайым гексогональды тор бойынша кристалданбаса. Бұл жоғарғы сатыдағы еркін энергиямен байланысты осы торлардың аз компактылығымен айтылады. Қарапайым кубтық ұйшық үшін (1.29-сурет) ұйшық көлеміне бір R шар келеді. Кубтың қырының ұзындығы а=2R. Ұяшық көлемі V=(2R)3 , шардың көлемі V=4/3PR3, сонда компактылық былай болады:
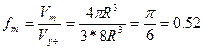
Көлемді орталықтанған кубтық ұяшықта шарлар куб диагоналі бойынша бір – біріне тиеді. (1.30 - сурет). Диагональдың ұзындығы 4R – ға тең және бұл жердегі ұяшық параметрлері a=4R/ 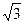 . Элементар ұяшық көлеміне екі шар керек, сонда
. Элементар ұяшық көлеміне екі шар керек, сонда
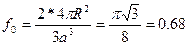
Шектік орталықтанған кубтық ұяшықта шарлар кубтың шекаралық диагоналі арқылы бір – біріне тиеді. (1.31 - сурет). Ұяшыққа төрт шар керек, сонда
|
|
|
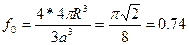
Гексанональды тығыз оралымға келесі қатынас сипатты болып табылады.
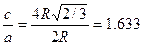
Олай болса, егер металл тығыз оралған оралымда кристалданса, онда с/а қатынасы шар өлшеміне тәуелді емес және 1,633 – ке тең болуы керек. Гексагональды тығыз оралған оралым типі бойынша көптеген Be,Cd,a – Ce, Hf,Mg,Ru,Ti,Zn,Zr металдар кристалданады.
Қатты дене атомды құрылымын анықтау әдісі.
Қатты денедегі атомды структураны анықтау үшін дифракциондық әдістер қолданылады. Әдістерді рентгенография, электронография және нейтронографияға бөледі. Бұл барлық әдістер толқын дифракциясының жалпы принципіне және кристалдық зат арқылы жүретін бөлікке негізделген.
Орта атомдар аралық қашықтық пен қолданылатын толқын ұзындығы арқылы дифракциондық картинаны алуға болады. Рентгенографияда атомдық структураны зерттеу үшін 0,7*10-10 – нен 3*10-10 толқын ұзындығына дейінгі рентгендік сәуле, электронографияда электрондар, нейтронографияда 10-10 ретті толқын ұзындығымен жылу нейтрондарын қабылдайды.
Дифракциондық картинаны рентгенография мен электронография жағдайында фотоплленкада немесе фотопластинкада фиксерлейді, ал нейтронография жағдайында Гейгер счетчигімен. Қатты дененің структуралық жағдайын дифракциондық картинада бірден сапалы қарауға болады. Егер дифракциондық картина нүктелік рефлекс жиынын көрсетсе, онда қатты дене монокристалды табылады. Егер дифракциондық картина концентрациялық сақина жиынын көрсетсе, онда қатты дене поликристалды жағдайда табылады. Егер дифракционды картинада максимум екі дифузды гало болса, онда дене аморфты жағдайда болады.Атомдық структураны білу – бұл кристалды элементар ұяшық көлеміне кіретін атомдар координаттар центрін білу. Реальды кристалдар - әртүрлі дефектілер нақтылығындағы кристалдар. Реальды кристалдар структурасын оқу өте қиын және дәл уақытта көптеген лабораторияларда реальды структура зерттеуімен жұмыс жасайды. Структураны зерттеу дифракциондық әдістер есептелген болып табылады. Есептеу структурасы үшін сыртқы информация түрінде оқылған объектінің экспериментінен алынған дифракциондық картина.
|
|
|
4- лекция. Атомаралық өзара әрекеттесу. Қатты денелердегі байланыстардың негізгі түрлері.
Қатты денелердің классификация және байланыс типтері.
Осы кезге дейін біз қатты денелерді дискретті бөлшектерден тұратын жүйе деп қарастырдық, кристалл торлардың симметриясына жәннне құрылысының заңдылықтарына көп көңіл бөлдік. Бөлшектерді тепе – теңдік қалыпта тұратын күштер туралы айтылмай келді. Кристалда бөлшектерді ұстап тұратын күштердің табиғаты, қиын молекулалардың пайда болуына әкелетін атомаралық күштердікіндей. Мұндай күштер деп негізінен қарама-қарсы зарядталған бөлшектер арасындағы электростатикалық тартылыс күші және біртекті зарядталған бөлшектер арасындағы тебулі күштері саналады. Кристалдағы бөлшектер арасындағы әсерлесу потенциялы көрсеткеніндей магниттік күштер өте аз ал гравитациялық күштерді жоқ деп санауға болмайды сонымен атомаралық әсерлесу күштері әсерлесетін атомдардың электронды қабықшаларының құрылуымен анықталады. Атомаралық күш қатты денелер классификациясының негізі. Осы классификацияға сәйкес қатты денелер төртке бөлінеді:
1.ковалентті
2.металды
3.ионды
4.молекулалық кристалды
Сутегімен байланысты органикалық емес заттардан тұратын кристалдарды бөлек типке жатқызады. Сутекті байланыс сутегі атомымен және теріс зарядталған атом арасындағы электростатикалық тартылыспен түсіндіріледі.
Қатты денелер классификациясының көптеген әдістері бар. Көптеген қатты денелерді кристал структурасының симметриясына, электрлік қасиетіне байланысты классификациялауға болады. Электрлік қасиетіне байланысты қатты денелер өткізгіштер және изоляторлар болып бөлінеді. Электр өткізгіштер болып металдар
|
|
|
(Ag, Cu, Ai)
Ал изоляторлар болып – ионды кристалдар табылады. Металдар мен изоляторлардың арасында жартылай металдармен жартылай өткізгіштер орналасады. Өте төмен температурада жартылай өткізгіштер изоляторларға айналады. Жартылай металдар, электронды өткізу концентрациясы металдарға қарағанда 104 есе аз болса да ток өткізеді. Мұндай айырмашылық электрондық құрылысының ерекшелігімен түсіндіріледі.
Бұл бөлімде біз жоғарыда айтылғандай әсерлесетін атомдардың электрондық қабықшаларының құрылуымен анықталатын, атомаралық әсерлесу күштеріне негізделген қатты денелердің классификациясын қарастырамыз. Әдеттегідей көптеген элементтерде атомаралық байланыста валентті электрондар қатысады.
Ag, Cu, Ai, En, Vb, Am
Осыларда электрондардың байланыс энергиясы толтырылған
d10, f10, f14
қабақшаларында атомаралық байланыста осы қабықшадағы бір – екі электрондар қатыса алады. Сыртқы қабықшасында көптеген валентті электрондары бар бірнеше элементтердің барлық валентті электрондары атомаралық байланысқа қатыса алмайды себебі атомдардың байланыс энергиясы жоғары
(O, F, Fe, Co, Ni және т.б.)
- атомдық нөмірінің өсуіне байланысты атомаралық байланысқа түсетін валентті электрондар саны периодты түрде өзгеріп отырады. Менделеевтің периодты заңына байланысты барлық физикалық, химиялық қасиеттер атомның өсуіне байланысты өзгеріп отыруы қажет,атомдар ионизациясының потенциялының атомдық нөмірге тәуелділігі көрсетілген. Бірінші ионизацияның потенциялы нейтрон атомнан электронның бөлінуі үшін қажет энергияға сәйкес келеді (2.1-тәуелділігі периодты сипаттаманы көрсетеді).
Металдары басқа ионизация потенциялы минимал элементтер мен салыстырғанда 5,4; 5,16; 4,35; 4,18; 3,90 Э – қа сәйкес келеді. Қабыршақты металдардың атомдарында тек қана бір валентті электрон бар, ол толтырылған қабықшаның сыртында орналасқан сондықтан әлсіз байланысты, сол себепті әртүрлі реакция кезінде бұл элементтер сыртқы электрондарын жоғалтып, оң зарядталған иондар катиондарды құрайды
Ui+,Na+,K+,Rb+,Cs+
Сыртқы электронды жоғалтқан электронды қабықшалар, өздерінде жақын инертті газдардың атомдарының қабықшалары сияқты болып қалады (He, Ne, Ar, Kr, Xe, Rn) өте берік электронды конфигурациясы бар бірінші ионизация потенциялы өте жоғары және 25/12, 25/12 Э – қа дейін өзгереді.
Инертті газдардың алдында галогендер орналасады 10-18-ге дейін эв бірінші ионизациялау потенциялы 1 бар периодты жүйенің 7-топ элементтері – F, CI, Вч, Ч, бұл элементтерде инертті газдардың атом қабықшасын құрау үшін 1-электрон жетпейді, олар теріс зарядталған иондар – аниондар болып табылады: F-, CI -, Вч-, Ч-, Анион пайда болғаннан кейінгі нейтрал атомнан бөлініп шығатын Е-эпизгиясын электронның атомға өсу энергиясы деп аталынады. Галодтары атомдар электронға көбірек қосылады:
Ғ -3,4эв, СІ – 3,6эв, Вч -3,4эв, Ч-3,1эв.
Ионизация потенциалы және электронға қосылу энергиясы иондық валенттікпен тығыз байланысты, ал атомның қосып алатын немесе жоғалтатын электрон сапамен анықталады. Қабыршақты металдар инертті элементтер атомына қарағанда бір электроны көп болғандықтан бір валентті оң зарядталған, мысалы Na – атомының иондық валенттігі +1 – ге тең. Галондты атомдар бір валентті теріс зарядталған, себебі оларда бір электрон жетіспейді сонымен СІ – атомы үшін иондық валенттігі -1 – ге тең.
Екінші атомдардың екі электронын жоғалта отырып инертті газдардың электронды структурасын құра алады.
Be2+, Mg2+,Ca2+,Sч2+
және бұл атомдар +2 – ге тең оң валентті; Үшінші топтың атомдары үш электрондарын жоғалтып валенттігі +3 – ге тең иондар құра алады.
Бір сападағы атомдарды басқа атомдармен әсерлесуінің химиялық байланысы олардың беретін немесе алатын валенттігімен анықталады. Бұл қасиет Х – атомдардың теріс электрон зарядтарымен қарастырылады. Теріс электрлі зарядталу бұл атомның қатты денеден электронды тарту тенденциясын көрсететін параметр, теріс элекрлі зарядталу атомдардың әсерлесуінің салыстырмалы шамасы және ол физикалық шама болып есептелмейді, себебі: ол тұрақты емес және химиялық байланыстағы атом табиғатына тәуелді. Кейде химиялық байланыс кезінде бір атом теріс электрлі және оң электрлі зарядталған болуы мүмкін. Теріс электрлі зарядталу кристалдық структурасына және байланыс типіне өте әлсіз тәуелді, қатты денелердің қасиеттерін қарастырғанда бұл атомдардың объективті қасиеттері болады. Атомдардың теріс электрлік зарядталуының шамамен алынған мәні, электронның өсу энергиясымен бірінші ионизация потенциалының орташа арифметикалық өрнегі: Х=1/2(Ч+Э)
(2.1) формула Менделеевтің периодты таблицадағы барлық элементтердегі теріс электрлі зарядталу мәніне қарап, бір қатарға жазуға болады, көріп отырғанымыздай Ғ – үшін 4 эв – қа дейін, Сs үшін – 0,7 эв дейін теріс электрлі зарядталу шамасы өзгереді. Фтор көбірек теріс электрлі зарядталған элемент периодта таблицаның әрбір қатары оң электрлі зарядталған элементтен басталады, яғни оң иондар түзетін элементтерден әрбір қатардың оң жақ бұрышында – теріс электрлі зарядталған элементтер орналасады. Яғни теріс иондар құрайтын элементтер сонымен таблицаның сол жағында металдық қасиеттері бар элементтері орналасады яғни металдар ал оң жағында металда жоқ элементтер металоидтар орналасады. Кестеден металдармен металоидтар арасында шартты шек жүргізуге болады. Бұл шек химиялық белгілеріне байланысты жүргізіледі. Тұз типті су ерітінділерінде ионды диссоциация жүретін, және соның әсерінен ерітінді дегидротерленген оң иондар, сонымен қатар теріс зарядталған иондар пайда болатынының белгісі, химиялық белгілердің бір түрі. Химиялық активті элементтерді металл мен металидқа бөлу байланыс типтің негізгі үш түрін енгізуге әкеледі: ионды, ковалентті және металды оң электрлі зарядталған металдармен терісс электрлі зарядтармен металиодтағы арасындағы байланыс иондық байланыс сияқты анықталады. Ол теріс зарядталған иондар арасында болғандықтан иондардың полярлығына қарап – гетеро полярлы деп аталады. Гомополярлыға металдық және ковалентті байланыс жатады. Металл мен металоид арасындағы байланыс – металдық, ал металоидтар мен бейметалдар арасындағы байланыс гейметалдар болып табылады. Қарастырылған байланыс типтері химиялық әсерлесудің салдарынан болады. Ал ковалентті байланыстар өте сирек кездеседі және иондармен сипатталады.
Ковалентті байланыстың иондық деңгейін өзара әсерлесетін А және В атомдарының теріс электрлі зарядталуы белгілі болған жағдайда ғана бағалауға ғана болады. Байланыстар сипаттамасын анализдеу кезінде әсерлесетін атомдардың теріс электрлі зарядталуының айырмасы қарастырылады. Иондық қосылудың мына өрнектен анықтаймыз: салыстырмалы иондылық
Ха – Хв =1-exp[-0625(ха-хв)](2,2)
Бұл жерде Ха – Хв - өзара әсерлесетін А және В атомдардың теріс электрлік зарядталуы.
Егер салыстырмалы иондық 1-ге тең болса, яғни 100% құраса, онда атомдар арасындағы байланысы – иондық; егер 0 – ге тең болса онда байланыс ковалентті.
О – мен 1 – аралығындағы ковалентті байланыс иондықта сипатталады. Теріс электрлі зарядталу айырмасы көп болған сайын байланыстың иондық сипаттамасы анығырақ болады.
Кристалдардағы иондық байланыстардың жиі кездесетін байланыс екендігін эксперимент жүзіндегі дәлелі томның эффективті заряды, ол Е – электрон зарядының бүтін санына тең емес 2.2 кесте кейбір қосылулардағы атомдардың эффективті заттары
| Қосылыс | Эффективті заряд |
| NaCl NaBr SiO2 Na2S ZnS | +0.92ℓ (сол Na) +0.83ℓ (сол Na) +1.97ℓ (сол Si) - 0.99ℓ (сол O) +0.75ℓ (сол Na) -0,96ℓ (сол S) - 0,86ℓ (сол S) |
2.2 кестеден көріп отырғанымыздай 1 элемент бірнеше әртүрлі қосылулар кезінде әртүрлі эффективті зарядқа ие болады. Мысалы: NaCl,
Na – атомының эффективті заряды +0,92 е – ге тең, ал NaBr+0.83 e құрайды.
Көріп отырғанымыздай әсерлесу кезінде атомдар арасында теріс электрлі зарядталу 0 – ге тең болғанша зарядтардың бөлінуі орын алады. Бір ғана атом көптеген атомдармен әсерлесе алады. Олардың әрқайсысының өзінің теріс элетр заряды және эффективті заряды әрбір қосылуларда әртүрлі болады.
Қатты денелердегі атомдар байланысы әсерлесетін күштердің табиғаты болғандықтан, молекулалардағы атомдар байланысының күшіне ұқсас, қатты денелердегі және молекулалардағы байланыс күштері өте ұқсас болып келеді. Сондықтан қатты денелердегі атмның байланыс энергиясының сан мәнін табу үшін, алдымен 2 – атомды молекулаларда атомдарды бірге ұстап тұратын күштерді қарастырамыз.
Екі А және В атомын қарастырамыз. Егер атомдар бір – бірінен алыс орналасса онда олар өздерін бос атомдар сияқты ұстайды. Ені изалияцияланған атомынан тұратын, мұндай жүйенің энергиясы, 0 – ге тең деп алуға болатын атомдардың энергиясының суммасына тең. Атомдар арақашықтықтары R C(rа+rв),rа және А және В атомының радиусы чв салыстырғанда үлкен болса олар бір – бірімен әсерлеспейді. Егер атомдар арасындағы арақашықтық азайса, жүйенің энергиясы изолияцияланған атом энергиясының суммасына қарағанда төмендейді, сөйтіп атомдар арасында тартылыс күші пайда болады да U жүйесінің (U+r) потенциалдық энергиясының азаюына сәйкес келеді. R=r0 арақашықтығында U(r) – энергиясы Ғ күшіне сәйкес келетін минимал мәнге жетеді: Ғ=-(эr/dr)rrо=0
2.3 формула. Бұл минимум міндетті түрде болу керек болмаған жағдайда ядролар арасында молекула құралмаған еді. Атомдарды ары қарай жақындатсақ олардың арасында ч-азайған сайын тез өсетін тебіліс күштері пайда болады, U(ч) потенциалдық энергияның өсуімен бірге жүреді. Тартылыс күшінің тебіліс күшінен ауысуы, тартылыс күшіне энергиямен тебіліс күшіне сәйкес келетін энергияның суммасы түрінде қарастырылатын толық потенциалдық энергиясымен өрнектеледі:
U (r)=Uпр (r)+Uот(r) 2.4. формула
2.2 суретте толық потенциалдық энергияға сәйкес келетін потенциалдар қисығы және суммалар қисығы көрсетілген Rr0 болғанда жүйенің минимум энергиясына сәйкес келетін тартылыс күші тебіліс күшімен теңеледі.
(Ғпр=Fот=0)
Сол кезде ядро атомдарының жиілігі –ω0= тербеліс жасайтын АВ молекуласы құрылады. Байқағанымыздай тепе – теңдікке жақындаған кезде U=U(r) қисығы параболаға сәйкес келеді, мұны Тейлор қатарындағы r=r0 бұрымына сәйкес U(r)
U(r)=U0(r0)+1/2(r-r0)2(d2u/dr2)r-r0 – 1/6(r-r0)3(d3u/dr3)r=r0+…..
2.5 формуладан, тепе – теңдік қалыптан ауытқыған атомдарды қайтарушы күш арақашықтыққа пропорционал екені және атомдардың гармоникалық оссилятор сияқты тербелетіні көрінеді. Кванттық механикадан білеміз, мұндай оссилятордың энергетикалық деңгейі төменгі өрнектеп алынады.
En=hω0(n+1/2)(n=1,2,3….)
(2.6) U0 – минимумының шегі молекулалардағы атомдардағы байланыс энергиясына тең. Байланыс энергиясы, алғашқы және соңғы күйлердегі жүйенің энергиясының потенциалдар айырымына тең. U=U1-U2. 2.7 формула жүйенің алғашқы күйі деп, бөлшектер бір – бірінен үлкен арақашықтықта болғанда және өзара әсерлеспегендегі күйін айтамыз, оны U1 – b деп алуға болады. Соңғы күйі жүйедегі бөлшектерді t=o кельвин болғандағы бөлшектердің тепе – теңдік қалпындағы күйін айтамыз. Жоғарыда айтылғаннан бөлек мына формуланы жазуғааа болады.
U1= - U2 (2.8 формула)
ω0 жиіліктегі 0 – дің тербелістерді өзгертуге алып келетін молекулалар үшін байланыс энергиясы былай өрнектеледі:
U0=hω0/2=U0-Е
|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 147; Нарушение авторских прав?; Мы поможем в написании вашей работы!