
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
В комплексных соединениях 2 страница
[Ag(фенантролин)]+бромпирогаллоловый красный (рис.7):

Рис.7. [Ag(фенантролин)]+бромпирогаллоловый красный.
1.5. Изомерия комплексных соединений
Среди комплексных соединений, так же как и среди органических веществ, широко распространено явление изомерии. Изучение изомерии комплексов впервые позволило установить их пространственное строение. Из многочисленных видов изомерии комплексных соединений важнейшими являются следующие.
Ионизационная изомерия
Изомеры характеризуются различным распределением ионов между внешней и внутренней сферами. Например, соль
[Co(NH3)5Br]SO4 - красно-фиолетового цвета, а её изомер
[Co(NH3)5SO4]Br - красного цвета. Строение этих изомеров подтверждает эксперимент: свежеприготовленный изомер
[Co(NH3)5Br]SO4 с ионами Ba2+ даёт осадок BaSO4 и не даёт
осадка AgBr с ионами Ag+; в то же время изомер
[Co(NH3)5SO4]Br с ионами Ag+ даёт осадок AgBr и не даёт осадка BaSO4 с ионами Ba2+.
Частный случай ионизационной изомерии – сольватная (гидратная) изомерия. Изомеры отличаются друг от друга различным распределением молекул растворителя (воды) между внутренней и внешней сферами комплексного соединения. Например,
CrCl3 ×6H2O существует в трёх изомерных формах: [Cr(H2O)6]Cl3 - серо-синего цвета, [Cr(H2O)5Cl]Cl2·H2O - светло-зелёного цвета, [Cr(H2O)4Cl2]Cl·H2O - тёмно-зелёного цвета. О строении этих солей можно судить, например, по электропроводности их растворов. Первая соль при диссоциации даёт четыре иона, вторая - три и третья - два. При взаимодействии с нитратом серебра из первой соли осаждаются все три иона хлора, из второй- два иона хлора, из третьей - только один ион.
Солевая изомерия
Такая изомерия наблюдается, когда лиганд осуществляет связь с комплексообразователем посредством нескольких входящих в него атомов. Например, соль жёлтого цвета [CoNO2(NH3)5]Cl2 и соль красного цвета [CoONO(NH3)5]Cl2. В первом случае имеется связь N-Co, во втором - связь O-Co.Данные вещества имеют аналоги среди органических соединений.
Соли [CoNO2(NH3)5]Cl2 соответствуют нитросоединениям
R-NO2, а соли [CoONO(NH3)5]Cl2 - нитритным эфирам.
Соли второго типа при действии минеральных кислот разлагаются с выделением азотистой кислоты. Выделение азотистой кислоты указывает на наличие группы –O-N=O.Об этом свидетельствует также окраска комплекса. Известно, что все соединения кобальта, в которых связь с лигандами осуществляется через азот,
- жёлтого цвета. Замена подобных лигандов, в которых связь с кобальтом осуществляется через кислород (вода, сульфогруппы и т.д.), вызывает появление красной и коричневой окраски.
Координационная изомерия
Характерна для веществ, содержащих несколько комплексных ионов, и заключается в различном распределении лигандов во внутренних координационных сферах этих ионов. Например, известны два координационных изомера состава CoCr(NH3)6(CN)6: [Co(NH3)6][Cr(CN)6] и [Co(CN)6][Cr(NH3)6]. При взаимодействии с нитратом серебра первое из этих соединений даёт труднорастворимый осадок Ag3[Cr(CN)6] и в растворе [Co(NH3)6](NO3)3; второе- осадок Ag3[Co(CN)6] и в растворе [Cr(NH3)6](NO3)3.
Оба центральных атома-комплексообразователя могут принадлежать одному и тому же элементу. Например:
[Co(NH3)4(NO2)2][Co(NH3)2(NO2)4] и [Co(NH3)6][Co(NO2)6].
Геометрическая изомерия (цис-, транс-изомерия)
Изомеры отличаются друг от друга пространственным расположением лигандов по отношению к комплексообразователю. Подобную изомерию проявляют только комплексные соединения, обладающие октаэдрическим и плоским строением. Например, [Pt(NH3)2Cl4] существует в виде следующих изомерных форм (рис.8):

цис -изомер транс -изомер
вещество оранжевого цвета вещество жёлтого цвета
Рис.8. Геометрические изомеры тетрахлордиамминплатины.
Формуле [Pt(NH3)2Cl2] отвечают следующие геометрические изомеры (рис.9):

цис -изомер транс -изомер
оранжевые кристаллы жёлтые кристаллы
Рис.9. Геометрические изомеры дихлордиамминоплатины.
Геометрические изомеры имеют также комплексные соединения, в состав которых входят бидентатные лиганды, в частности, этилендиамин. Пространственное строение этих изомеров для соединения [Cr(NH2CH2CH2NH2)2Cl2]Cl (рис.10):

цис -изомер транс -изомер
фиолетового цвета серо-зелёного цвета
Рис.10. Геометрические изомеры иона дихлордиэтилендиамин
хрома(III).
Два геометрических изомера существуют и в случае комплексных соединений типа МеА3В3. Например, изомеры иона тригидроксотринитрокобальтата(III) [Co(NO2)3(OH)3]3-(рис.11):

цис - изомер транс -изомер
Рис.11. Геометрические изомеры иона
тригидроксотринитрокобальтата(III).
При увеличении количества неодинаковых лигандов число геометрических изомеров растёт, и чем сложнее состав молекулы, тем больше возможностей для проявления изомерии. Так, для комплексного соединения, содержащего во внутренней сфере 6 различных лигандов, могут существовать 15 геометрических изомерных форм:

Оптическая (зеркальная изомерия)
Оптические изомеры отличаются по оптической активности. Оптически активными являются вещества, способные вращать плоскость поляризации света. Один из оптических изомеров (антиподов) вращает плоскость поляризации вправо – это правый или D-изомер, другой влево, это – левый или L-изомер.
Оптическая активность комплексного соединения может быть обусловлена либо ассиметрией молекулы в целом, либо асимметрией входящего в молекулу лиганда. В последнем случае асимметрия может иметь место у свободного лиганда (например, у
d-пропилендиамина), либо появиться вследствие координации.
Оптическая изомерия наблюдается у комплексных соединений, молекулы которых не обладают ни центром симметрии, ни плоскостью симметрии. Так, комплексный ион хлороамминдиэтилендиаминкобальта(III) [CoClNH3(NH2CH2CH2NH2)2]2+ существует в виде двух геометрических изомеров (рис.12):
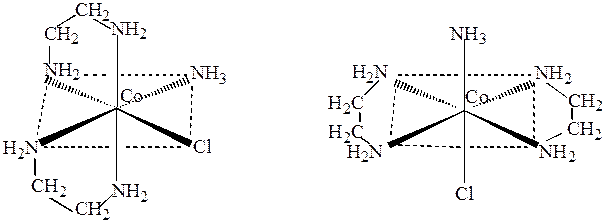
цис -изомер транс -изомер
Рис.12. Геометрические изомеры катиона
хлороамминдиэтилен диаминкобальта(III).
В транс -изомере [CoClNH3(NH2CH2CH2NH2]2+ имеется плоскость симметрии, проходящая через вершины октаэдра, занятые аммиаком и хлором. В цис -изомере такой плоскости нет, поэтому он является асимметрическим и может существовать в виде двух оптических изомеров (рис.13):

Рис.13. Оптические изомеры катиона
цис-хлороамминдиэтилендиаминкобальта(III).
Как видно из рис.13, расположение лигандов в оптических изомерах таково, что молекулы этих изомеров относятся между собой как предмет к его зеркальному изображению.
Оптические изомеры существуют и в том случае, когда лигандами являются только бидентатные молекулы этилендиамина (рис.14):

Рис.14. Оптические изомеры триэтилендиаминкобальта(III).
В октаэдрических комплексах с 6 разнородными лигандами, например, в [Pt(Br)(Cl)(NH3)(I)(NO2)(NC5H5)] каждый из 15 возможных геометрических изомеров может иметь по два оптических антипода. Таким образом, число изомеров увеличивается до 30.
Для комплексных соединений с координационным числом 4 оптические изомеры есть только у тетраэдрических комплексов с четырьмя разнородными лигандами. Так, например, оптические антиподы имеют четырёхзамещённые ионы аммония:

где R1,R2,R3,R4 – различные органические радикалы.
По своим физическим и химическим свойствам оптические изомеры практически не отличаются друг от друга, за исключением реакций с другими оптически активными веществами и физическими свойствами в хиральной среде. Физиологическое воздействие оптических антиподов, следовательно, может быть различным.
Глава 2. Природа химической связи
2.1. Электростатическая теория
Образование многих комплексных соединений можно в первом приближении объяснить электростатическим взаимодействием между центральным атомом-комплексообразователем и лигандами. Наряду с силами притяжения между разноименно заряженными ионами или между ионами и дипольными молекулами действуют силы электростатического отталкивания между одноимённо заряженными или одинаково ориентированными лигандами (в случае полярных молекул). Расчёты В.Косселя и А.Магнуса, которые принимали ионы за недеформируемые шары и учитывали их взаимодействие по закону Кулона, показали, что комплексные ионы, состоящие из иона-комплексообразователя и ионов лигандов, – это более устойчивые системы, чем простые молекулы. Было рассчитано, что наиболее устойчивые системы образуются в том случае, если число внутрисферных заместителей соответствует координационному числу центрального атома.
Наиболее выгодные численные значения координационного числа согласно этой теории обусловлены как величиной зарядакомплексообразователя, так и зарядом лигандов. Увеличение заряда комплексообразователя вызывает увеличение силы притяжения между лигандами и комплексообразователем. Это приводит к увеличению координационного числа. С другой стороны, увеличение заряда лигандов вызывает как увеличение силы притяжения между ними и комплексообразователем, так и увеличение силы взаимного отталкивания. Поэтому в случае двухзарядных лигандов координационное число меньше, чем в случае однозарядных. Так, однозарядные комплексообразователи образуют комплексные ионы с координационным числом 2 ([Ag(CN)2],-
[AgCl2]-, [CuCl2]- и т.д.), двухзарядные – в основном, с координационным числом 4 ([BeF4]2-, [Cd(CN)4]2-, [PtCl4]2-, [HgI4]2- и т.д.), трёхзарядные–с координационными числами 4 и 6 ([BF4]-,
[AlCl4]-, [FeF6]3- и т.д.).
Согласно теории более прочные комплексные соединения образуются в тех случаях, когда комплексообразователь имеет небольшие размеры. Например:устойчивость комплекса [AlF6]3-больше, чем комплекса [ScF6]3-, а устойчивость комплекса [Al(C2O4)3]3- больше, чем [Sc(C2O4)3]3-, так как ионный радиус Al (0,57Ао) меньше ионного радиуса Sc(0,83Ао). Аналогично, уменьшение ионного радиуса лиганда приводит к увеличению прочности комплексного соединения. Так, устойчивость комплексного иона уменьшается в следующем порядке:
[AlF4]- > [AlCl4]- > [AlBr4]- > [AlI4]-, так как ионные радиусы лигандов {F- (1,33Ао) < Cl-(1,81Ао) < Br-(1,96Ао) < I-(2,20Ао)}
увеличиваются.
Магнус рассчитал энергию образования комплексных соединений, в которых лигандами являются дипольные нейтральные молекулы. При этих расчётах было принято, что как ионы, так и молекулы представляют собой недеформируемые шарики и что в результате образования координационной связи величина диполя нейтральных молекул не изменяется. Полученные таким образом наиболее выгодные значения координационного числа обычно выше, чем в аналогичных случаях, когда лигандами являются ионы. Это объясняется тем, что между дипольными молекулами действуют гораздо меньшие силы отталкивания, чем между ионами-лигандами. Например:
[Co(NCS)4]2-и [Co(C2O4)2]2-, но [Co(NH3)6]2+ и [Co(Н2O)6]2+.
Однако простая электростатическая теория не принимает во внимание природу центрального атома и лигандов, особенности строения их электронных оболочек. Поэтому теория Косселя-Магнуса была дополнена поляризационными представлениями, учитывающими эти особенности и изменения, претерпеваемые ионами и дипольными молекулами при их взаимодействии. Сущность явления поляризации состоит в смещении центров тяжести положительного и отрицательного зарядов в ионах, атомах и молекулах. Так, известно, что катионы типа щелочных и щелочно-земельных металлов не образуют прочных аммиачных комплексов в водном растворе, но образуют довольно устойчивые аквакомплексы. В то же время аммиачные комплексы ионов Cu2+,Ag+,Zn2+ и другие более устойчивы в водных растворах, чем аквакомплексы этих ионов. Это объясняется следующим образом. Катионы с оболочкой инертного газа (ионы щелочных металлов) создают слабое электростатическое поле и поэтому способны координировать молекулы, обладающие высоким дипольным моментом (молекулы воды). Аммиак имеет более низкий, чем вода, постоянный дипольный момент, но более высокую поляризуемость. Поэтому под влиянием сильно поляризующих катионов d-элементов общий дипольный момент аммиака становится выше, чем у воды. В результате такие катионы легко координируют аммиак. В приложении поляризационных представлений к явлениям комплексообразования учитывается не только поляризуемость лигандов, но и деформация электронных оболочек центральных атомов, обеспечивающая взаимное проникновение электронных оболочек центральных атома и лигандов. Например, поляризационные представления хорошо объясняют образование и закономерности поведения полигалогенидов. Ионы I- и молекулы I2 легко поляризуются. При сближении этих частиц в каждой из них возникает индуцированный диполь за счёт взаимной поляризации. Дальнейшее взаимодействие диполей приводит к образованию системы, устойчивой даже в водном растворе.
В процессе образования полигалогенидов важную роль играет способность комплекосообразователя к деформации. Поэтому устойчивость полигалогенидов возрастает с увеличением размеров комплексообразователя. Вследствие этого полифториды вообще неизвестны, а устойчивость остальных полигалогенидов возрастает в ряду:[Cl·I2]- < [ Br·I2]- < [Br·I2]- < [I·I2]-. С другой стороны, устойчивость полигалогенидов возрастает и с увеличением деформируемости лигандов. Таким образом, самыми устойчивыми полигалогенидами являются соединения, содержащие в качестве комплекообразователя ион йода и в качестве лигандов молекулы иода, т.е. полииодиды. Так как при увеличении количества нейтральных молекул они связываются всё более и более слабо, из полииодидов самым устойчивым является трииодид.
Кроме трииодидов существуют аналогичные соединения брома, например, RbBr3, CsBr3 .Образуются также смешанные полигалогениды: [Br·I2]-, [[I·Br2]-, [I·Cl2]-.
Конечно, некоторое влияние на устойчивость полигалогенидов имеют и свойства металла, входящего в их состав. Чем более сильным поляризатором является этот ион, тем больший индуцированный диполь он создаёт в комплексообразователе. Увеличение индуцированного диполя уменьшает силу взаимодействия комплексообразователя с лигандами, тем самым ослабляя связь между ними. В результате более устойчивыми должны быть те полигалогениды, которые содержат слабополяризующие ионы металлов. В соответствии с экспериментальными данными самые устойчивые полигалогениды содержат ионы калия, рубидия и цезия. Получить полигалогениды сильно поляризующих катионов (например, элементов побочных подгрупп) либо совсем не удаётся, либо они являются очень неустойчивыми. Легко получаются такие полигалогениды, катионы которых являются комплексными ионами, например [Cu(NH3)4][I3]]2,
[Ni(NH3)4][I7]2 и др. Благодаря большим размерам комплексный катион является очень слабым поляризатором и не мешает образованию полигалогенидов. Из полигалогенидов комплексных ионов ещё необходимо отметить полииодиды четырехзамещенных ионов аммония: [N(CH3)4][I3], [N(CH3)4][I5], [N(CH3)4][I5], [N(CH3)4][I7], [[N(CH3)4][I9].
Поляризационные представления позволяют объяснить обратную зависимость устойчивости комплексного иона от его размера. По устойчивости галогениды двухвалентной ртути располагаются следующим образом:[HgI4]2- > [HgBr4]2- > HgCl4]2-. Ионные радиусы уменьшаются в том же направлении: I- (2,20А0) > Br-(1,96А0) > Cl-(1,81А0). Ион Hg2+ обладает сильной поляризующей способностью и, кроме того, способен сам довольно хорошо поляризоваться. Способность к деформации лигандов в ряду
Cl-, Br-, I- быстро возрастает вследствие увеличения ионных радиусов. Поэтому сильно увеличиваются и поляризационное взаимодействие между комплексообразователем и лигандами и, следовательно, при возрастании размеров лигандов устойчивость комплексного иона увеличивается,
Поляризационные представления позволяют объяснить, почему могут образовываться устойчивые комплексные соединения в тех случаях, когда соответствующие соединения первого порядка являются малоустойчивыми. Например,PbI4 и PbBr4 вообще нельзя получить, а PbCl4 медленно разлагается уже при ОоС. Хотя комплексные соединения K2[PbI6], K2[PbBr6], K2[Cl6] при обычной температуре являются вполне устойчивыми и не разлагаются даже при небольшом нагревании. В соединениях PbCl4, PbBr4 и PbI4 поляризующее действие Pb+4 распределяется между четырьмя ионами галогена. Оно оказывается настолько сильным, что свинец оттягивает от двух ионов галогена по электрону и переходит в двухвалентное состояние: PbBr4 = PbBr2 + Br2.
В комплексных соединениях типа K2[PbBr6] поляризующее действие Pb+4 распределяется на 6 лигандов. Поэтому каждый
лиганд поляризуется в меньшей степени и комплексообразователь уже не в состоянии полностью оттянуть от них электроны.
Поляризация сильно влияет на свойства комплексных соединений и в тех случаях, когда лигандами являются нейтральные молекулы. Многие из них являются полярными. При попадании полярной молекулы в электростатическое поле комплексообразователя она сначала ориентируется, затем приближается к комплексообразователю до соприкосновения с ним. Электростатическое поле вызывает в молекуле некую деформацию, в результате создаётся дополнительный индуцированный дипольный момент, который упрочняет связь между комплексообразователем и лигандами. В некоторых случаях относительная устойчивость комплексных соединений в сильной мере зависит именно от величины индуцированного дипольного момента. Так, для воды постоянный дипольный момент (µ =1,85) больше, чем у аммиака
(µ =1,49).Однако это не означает, что гидраты должны быть устойчивее аммиакатов. В действительности даже в водных растворах, в которых концентрация воды во много раз больше концентрации аммиака, весьма легко образуются аммиакаты. Так, в водном растворе солей меди молекулы аммиака вытесняют молекулы воды из внутренней сферы:
[Cu(Н2O)4]2+ + 4NH3 D [Cu(NH3)4]2+ + 4H2O.
Это происходит потому, что ион меди создаёт больший индуцированный момент в молекулах аммиака, чем в молекулах воды. Вследствие этого общий дипольный момент, который определяет прочность связи между ионом меди и нейтральными молекулами, оказывается большим именно в случае молекул аммиака.
Если комплексообразователь не обладает сильными поляризующими свойствами, то в лиганде создаётся сравнительно маленький индуцированный дипольный момент. Общий дипольный момент молекул аммиака при этом может оказаться меньше общего дипольного момента молекул воды, и в таком случае гидраты более устойчивы, чем аммиакаты. Например, ионы щелочноземельных металлов не образуют аммиакатов в воде.
Электростатическая теория проста и наглядна. Она дала удовлетворительное качественное объяснение образованию большинства комплексных соединений. Количественно эта теория позволяет вычислить наиболее вероятные координационные числа, энергию образования, а также получить некоторые сведения о пространственном расположении лигандов. Однако не всегда полученные расчётные значения совпадают с опытом. Электростатическая теория не в состоянии объяснить особенности реакционной способности комплексных соединений, их магнитные свойства, окраску и др.
2.2. Метод валентных связей
Применение метода валентных связей к комплексным соединениям принадлежит Полингу. Полинг показал, что, используя метод валентных связей, можно предсказать геометрическую форму и магнитные свойства комплексов. Теория метода валентных связей объясняет образование комплексов за счёт донорно-акцепторной или координационной связи. Эта связь, как частный случай ковалентной связи, осуществляется между атомом - комплексообразователем, имеющим свободные орбитали и являющимся акцептором электронов, и лигандами, имеющими неподелённые электронные пары, донорами которых они являются. Донором может быть и комплексообразователь. Когда координационная связь образована, она практически ничем не отличается от обычной ковалентной связи.
Например, в комплексном ионе [BF4]- донором электронной пары служит анион фтора, а акцептором - атом бора в молекуле BF3 , обладающий незанятой орбиталью внешнего электронного слоя и переходящий при комплексообразовании в состояние
sp3- гибридизации (конфигурация иона – тетраэдр).
Следующие комплексы: [Zn(NH3)4]2+,[Cd(NH3)4]2+, [HgI4]2-
также имеют геометрическую конфигурацию тетраэдра (рис.15):

Рис. 15. Структура комплексного катиона [Zn(NH3)4]2+.
Образование этих комплексных ионов можно объяснить тем, что ионы цинка, кадмия и ртути, имея четыре свободных орбитали (Zn2+- одну 4s и три 4р- орбитали, Cd2+- одну 5s и три 5р -орбитали, Hg2+- одну 6s и три 6р-орбитали) могут быть акцепторами электронных пар лигандов, причём осуществляется
sр3 –гибридизация, соответствующая размещению лигандов в вершинах тетраэдра:
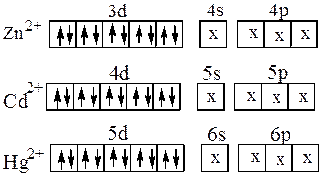
Координационному числу 2 отвечает sp-гибридизация и линейная координация лигандов, как, например, в комплексе
[Ag(NH3)2]+:

Кроме тетраэдрической конфигурации координационному числу 4 соответствует так же квадратная координация лигандов, как, например, в комплексах [Pt(NH3)4]2+, [Pd(NH3)4]2+, [AuCl4]-(рис.16):

Рис. 16. Структура комплексного катиона [Pd(NH3)4]2+.
Ионы Pt2+,Pd2+,Au3+, имея четыре занятых d –орбитали, предоставляют для электронных пар лигандов одну d, одну s и две р-орбитали. При этом осуществляется гибридизация dsр2:



Наиболее распространённым координационным числом является 6, которому соответствует гибридизация d2sp3 или sp3d2 и октаэдрическое расположение лигандов. Такая структура комплекса характерна для Cr3+,Co3+,Pt4+,Fe3+, Fe2+ и многих других.
Например: Cr3+ имеет две свободные 3d –, одну 4s –и три
4р – орбитали, которые они предоставляют для электронных пар лигандов, при этом осуществляется d2sp3- гибридизация. Комплексный ион [Cr(CN)6]3- (рис.17) содержит три неспаренных электрона и, следовательно, парамагнитен:


Рис.17. Структура комплексного аниона [Cr(CN)6]3-.
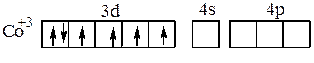
Рассмотрим также два комплексных иона Co3+:
[Co(NH3)6]3+ и [CoF6]3-.
Известно, что первый из них диамагнитен, второй парамагнитен.
Ион-комплексообразователь в этих комплексных ионах имеет электронную конфигурацию 3d6. В соответствии с правилом Хунда эти шесть электронов в d–состоянии располагаются по энергетическим ячейкам следующим образом:
При образовании комплексного иона [Co(NH3)6]3+ четыре
d-электрона сначала образуют электронные пары, освобождая две 3d–орбитали:

Затем образуется ион [Co(NH3)6]3+, имеющий строение

При образовании этого комплекса имеет место d2sp3 -гибридизация, причём она осуществляется при участии внутренних d-орбиталей третьего энергетического уровня иона Co3+. В случае иона [CoF6]3- образования пар d-электронов в ионе Co3+ не происходит. Шесть неподелённых электронных пар ионов F- располагаются в свободных s-,p-, d- орбиталях четвёртого энергетического уровня. Комплексный ион [CoF6]3- имеет строение:
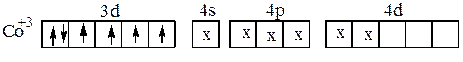
|
|
Дата добавления: 2017-02-01; Просмотров: 125; Нарушение авторских прав?; Мы поможем в написании вашей работы!