
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Периода в водном растворе
|
|
|
|
| Общее число d-электронов в ионе металла | Ион металла | Цвет |
| K+,Ca2+,Sc3+ | бесцветный | |
| Ti3+ | фиолетовый | |
| V3+ | зелёный | |
| Cr3+ | фиолетовый | |
| Cr2+ | голубой | |
| Mn2+ | бледно-розовый | |
| Fe2+ | зелёный | |
| Co2+ | розовый | |
| Ni2+ | зелёный | |
| Cu2+ | голубой | |
| Cu+,Zn2+,Ga3+ | бесцветный |
Окраска комплекса зависит от его состава и строения, и определяется длиной волны l max, отвечающей максимуму полосы поглощения и интенсивностью полосы. В спектрах поглощения комплексных соединений d- элементов имеются полосы поглощения низкой интенсивности, которые проявляются в видимой области, а иногда несколько сдвинуты в фиолетовую область. Их появление связано с электронными переходами в незаполненных d- орбиталях.
Необходимо иметь в виду, что в свободном атоме или ионе запрещены следующие типы переходов:
а) переходы, в которых число неспаренных электронов изменяется. Такие переходы называют запрещёнными по спину.
б) переходы, в которых происходит перераспределение электронов между группами орбиталей, имеющих те же значения квантовых чисел n и l. Это называют правилом отбора Лапорта.
Положение полосы поглощения определяется величиной расщепления в кристаллическом поле. Значение энергии расщепления и соответственно положение полос поглощения могут меняться в широких пределах. Изъятие из потока света, падающего на поглощающее свет вещество, части энергии, отвечающей поглощённой длине волны, приводит к тому, что возникает окрашивание, соответствующее действию на глаз человека непоглощённых длин волн. Например, из солнечного спектра раствором [Ti(H2O)6]3+ поглощаются зелёные волны, поэтому мы воспринимаем растворы комплексов Ti3+ как имеющие красно-фиолетовое окрашивание.
|
|
|
Оранжевое окрашивание комплекса [Co(NH3)6]3+ указывает на поглощение в сине-фиолетовой части спектра, т.е. в области коротких волн и, следовательно, расщепление для этого комплекса -большая величина (комплекс низкоспиновый). Голубое окрашивание комплекса [CoF6]3- означает, что он поглощает энергию в жёлто-красной, т.е. длинноволновой части спектра. Величина расщепления в этом случае мала, так как анион фтора образует лишь слабое поле.
Невозможностью d- электронных переходов объясняется отсутствие или её низкая интенсивность у следующих комплексных соединений: [Au(CN)4]-, [Co(CN)6]3-, [Cu(NH3)2]+, [Zn(NH3)4]2+. В комплексах Cu(I) и Zn(II) центральный ион имеет замкнутую электронную оболочку(d10 -конфигурация). Цианидные комплексы Au(III) и Co(III), как и многие другие цианиды, не окрашены, поскольку принадлежат к числу низкоспиновых комплексов (ион циана - лиганд сильного поля). В этих комплексах реализуются d8 и d6- электронные конфигурации, для которых d-d переход энергетически запрещён.
Спектрохимический ряд лигандов записан таким образом, что наблюдаемая энергия первой полосы поглощения (Δ) для данного иона в этом ряду повышается. Например, ион Cu2+ в кристаллическом CuSO4·5H2O и в водном растворе находится в октаэдрическом поле четырёх молекул воды и имеет характерную светло-голубую окраску. В аммиачном растворе окраска изменяется на интенсивносинюю. Это изменение связано с изменением вида лиганда с соответствующим повышением Δ, что приводит к сдвигу поглощения в сторону более высоких частот. С другой стороны, безводный сульфат меди бесцветен, так как поле лигандов сульфат-иона в этом случае настолько слабое, что d-d – полоса поглощения сдвигается в инфракрасную область.
Если комплекс не имеет центра симметрии (тетраэдрический комплекс), то d- и p-(или f-) орбитали центрального атома могут стать гибридными. При этом орбитали перестают быть эквивалентными и электронные переходы могут происходить в зависимости от степени гибридизации. Таким образом, интенсивности
|
|
|
d-d переходов в тетраэдрических комплексах должны быть намного больше. Этим, в частности, объясняется изменение цвета соединений Co(II) от светло-красного октаэдрического иона [Co(H2O)6]2+ в водном растворе до интенсивносиних галогенидов Co(II) в органических растворителях или в присутствии избытка галогена в растворе, что можно приписать образованию тетраэдрического иона типа [CoCl4]2-. Аналогично различаются цис- и транс- изомеры: так, комплексу цис-[Co(NH3)4Cl2]+ отвечают более интенсивные полосы, чем соответствующему транс-изомеру, так как первый не имеет центра симметрии, и запрещённый по Лапорту переход станет разрешенным при гибридизации d- и
p- орбиталей.
Большая интенсивность поглощения наблюдается у соединений d- переходных элементов типа MnO4-, CrO42- и др. Чаще всего в таких системах перемещение электрона осуществляется с лиганда (в данном случае с атомов кислорода) на центральный ион Mn(VII) или Cr(VI). Такой переход не запрещён, поэтому интенсивность поглощения очень велика.
3.2. Магнитные свойства комплексных соединений
Известно, что магнитные эффекты делятся на два типа. один из которых возникает вследствие движения электронов, другой –
из-за наличия у электронов спинового и орбитального моментов. Первый из этих эффектов обуславливает явление диамагнетизма, второй - парамагнетизма. Спиновые и орбитальные моменты электронов обуславливают явление парамагнетизма и связанных с ним явлений ферромагнетизма и антиферромагнетизма. Молекулы с целиком заполненными электронными оболочками не обладают магнитными свойствами, так как не имеют вырожденных состояний, способных расщепляться под действием магнитного поля. Но, поскольку магнитное поле индуцирует в заполненных оболочках небольшой магнитный момент, противоположный внешнему полю, такие молекулы выталкиваются из магнитного поля. Такие молекулы называются диамагнитными. Молекулы, имеющие неспаренные электроны, втягиваются в магнитное поле и называются парамагнитными.
В большинстве комплексных соединений ионы металлов, являющиеся единственными источниками парамагнитных эффектов, изолированы друг от друга большим количеством магнитно инертных атомов лигандов. Это магнитное разбавление парамагнитных центров обычно сильно уменьшает взаимодействия, приводящие к ферромагнетизму и антиферромагнетизму.
|
|
|
Диамагнетизм и парамагнетизм – эффекты противоположные, поэтому при расчёте магнитного момента комплекса металла приходится учитывать диамагнетизм лиганда. В любом случае поле внутри образца, называемое магнитной индукцией В, отличается от поля в свободном пространстве Н:
® ® ®
В = Н + 4pI,
где I - интенсивность намагничивания, т.е. степень ориентации диполей или поляризации заряда, индуцированного полем. Наиболее существенной с химической точки зрения величиной является молярная магнитная восприимчивость cм. Магнитную восприимчивость измеряют экспериментально (методами Гуи, Фарадея или с помощью ЯМР). Используя найденное значение, в соответствии с теорией магнитной и электрической поляризации можно вычислить величину магнитного момента:
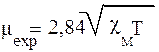
Исходя из предполагаемой электронной конфигурации иона-комплекообразователя можно рассчитать величину магнитного момента по уравнению квантовой механики (μth):
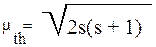
Значение суммарного спина системы рассчитывают по формуле s=0,5n для заданного числа «n» неспаренных электронов. Значение mth для числа «n» неспаренных электронов, равного 1,2,3,4,5 равно соответственно:1,73; 2,83; 3,87; 4,90; 5,92 магнетонов Бора(mB). Например, высокоспиновый комплекс Mn(II) - [Mn(H2O)6]2+ должен иметь 5 неспаренных электронов
(d5 - конфигурация). Величины mth (5,92 магнетонов Бора) и mexp(5,86 магнетонов Бора) близки, следовательно, теоретическое предсказание верное. Из табл.4 видно, что «чисто спиновая формула» находится в хорошем соответствии с наблюдаемым магнитным моментом.
Для диамагнетиков характерна отрицательная магнитная восприимчивость, для парамагнетиков - положительная. Эффект парамагнетизма - положительная магнитная восприимчивость –резко возрастает, если в структуре вещества парамагнитные ионы или атомы взаимодействуют друг с другом, сближаясь на короткие расстояния. Такой эффект называется ферромагнетизмом.
|
|
|
Парамагнитные ионы могут взаимодействовать друг с другом непосредственно, сближаясь на короткое расстояние, либо через мостиковые лиганды. При этом парамагнитные центры ориентируют свои магнитные поля в противоположных направлениях – возникает эффект антиферромагнетизма. Эффект антиферромагнетизма приводит к уменьшению магнитного момента и иногда к диамагнетизму, когда находящиеся по соседству ионы металла объединяют свои неспаренные электроны, либо непосредственно образуя ковалентную связь, либо прямо перенося их через лиганд. Поскольку полиметаллические центры довольно часто встречаются в металлоферментах и других биологических системах вопросы антиферромагнетизма имеют большое значение. Эта проблема существенна для понимания магнитных свойств железосеропротеинов, содержащих два,четыре или восемь атомов железа на 1 моль белка, переносчиков молекулярного кислорода гемэритрина и гемоцианина, содержащих пары антиферромагнитно связанных ионов железа и меди соответственно, некоторых медьсодержащих оксидаз, а также оксигемоглобина, диамагнетизм которого связан с наличием низкоспинового железа(II) и синглетного кислорода или железа(III), антиферромагнитно связанного с супероксид-ионом.
Детальная теория магнитных свойств показывает, что парамагнетизм иона связан с общим угловым моментом неспаренных электронов, а не с их числом.
Таблица 4. Магнитные свойства d -элементов 4 периода
| Кон- фи гура- ция | Элемент | Высокоспиновые октаэдрические комплексы | Низкоспиновые октаэдрические комплексы | ||
| mрасч μth | mэксп μexp | mрасч μth | mэксп μexp | ||
| do | Sc(III) | диамагнитны | |||
| Ti(IV) | |||||
| V(V) | |||||
| Cr(VI) | |||||
| Mn(VII) | |||||
| d1 | Ti(III) | 1,73 | 1,7-1,8 | ||
| V(IV) | |||||
| Mn(VI) | |||||
| d2 | Ti(II) | 2,83 | 2,75-2,85 | ||
| V(III) | |||||
| Fe(VI) | |||||
| d3 | V(II) | 3,87 | 3,7-3,9 | ||
| Cr(III) | |||||
| Mn(IV) | |||||
| d4 | Cr(II) | 4,90 | 4,8-4,9 | 2,83 | 3,20-3,30 |
| Mn(III) | |||||
| Fe(IV) | |||||
| d5 | Mn(II) | 5,92 | 5,85-5,95 | 1,73 | 1,8-2,4 |
| Fe(III) | |||||
| d6 | Fe(II) | 4,90 | 5,1-5,7 | диамаг-нитны | |
| Co(III) | |||||
| Ni(IV) | |||||
| d7 | Co(II) | 3,87 | 4,3-5,2 | 1,73 | 1,8-2,0 |
| Ni(III) | |||||
| d8 | Ni(II) | 2,83 | 2,8-3,5 | диамаг- нитны | |
| Cu(III) | |||||
| d9 | Cu(II) | 1,73 | 1,7-2,0 | ||
| d10 | Cu(I) | ||||
| Zn(II) |
3.3. Равновесия в растворах комплексных соединений
Для растворов комплексных соединений характерны следующие превращения:
а) диссоциация на комплексный и внешнесферный ионы, которая протекает почти нацело по типу диссоциации сильных электролитов, например:
K3[Fe(CN)6]® 3K+ +[Fe(CN)6]3-
[Cu(NH3)4](OH)2® [Cu(NH3)4]2+ + 2OH-
б) образование и диссоциация комплексного иона или замещение лигандов молекулами растворителя.
Образование и диссоциация комплексных соединений происходит ступенчато:

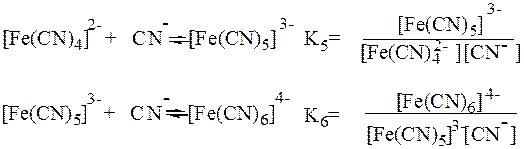
Общая константа образования комплекса b6 равна произведению ступенчатых констант образования:
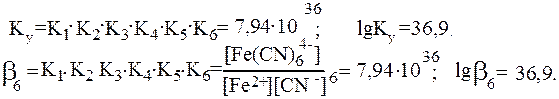
Константы Кn и b (или Ку) являются термодинамическими характеристиками устойчивости комплекса в растворе. Величина, обратная константе образования, называется константой нестойкости комплекса Kн = 1/ b.
Величина константы образования является мерой устойчивости комплекса. Так, комплекс [Co(NH3)6]3+ более устойчив, чем [Cu(NH3)4]2+, поскольку константы устойчивости у них соответственно равны:1,99×1035 и 1,07×1022.
Поскольку образование комплексного иона происходит в результате обмена воды гидратированного иона на соответствующие лиганды, более точно процесс комплексообразования называется обменом лигандов. При добавлении аммиака в водный раствор соли меди связанная с медью вода последовательно замещается аммиаком:
[Cu(H2O)4]2+ +NH3 = [Cu(NH3)(H2O)3]2+ +H2O
[Cu(NH3)(H2O)3]2+ + NH3 = [Cu(NH3)2(H2O)2]2+ +H2O
[Cu(NH3)2(H2O)2]2+ +NH3 = [Cu(NH3)3(H2O)]2+ + H2O
[Cu(NH3)3(H2O)]2+ +NH3 = [Cu(NH3)4]2+ +H2O
К этому обратимому последовательному процессу можно применить закон действующих масс. Константа равновесия, соответствующая суммарной реакции
[Cu(H2O)4]2+ + 4NH3 = [Cu(NH3)4]2+ +4H2O,
является суммарной константой образования или константой устойчивости данного комплекса β4 (или Ку):

Реакцией, обратной комплексообразованию, является реакция диссоциации.  Диссоциация также протекает ступенчато, причём при обмене лигандов с водой координационное число обычно остаётся неизменным. Между константой равновесия и рК прямой и обратной реакций имеет место следующее соотношение:
Диссоциация также протекает ступенчато, причём при обмене лигандов с водой координационное число обычно остаётся неизменным. Между константой равновесия и рК прямой и обратной реакций имеет место следующее соотношение:
Ку(β)=1/Кн; рКу= -рКн,где Кн-константа нестойкости (диссоциации).
3.4. Устойчивость комплексных соединений
Устойчивость комплексных соединений определяется как внешними условиями (температура, природа растворителя, ионная сила, состав раствора), которые учитываются при расчёте условной константы устойчивости, так и фундаментальными факторами. Такими факторами являются: природа центрального атома и донорных атомов лигандов, структура лигандов и стерические факторы.
3.4.1. Природа центрального атома и лигандов
Согласно теории Льюиса, комплексообразование можно рассматривать как один из видов кислотно-основных равновесий, в котором роль кислоты играет центральный ион (акцептор электронов), а роль основания –лиганды(доноры электронов). В соответствии с теорией Льюиса все кислоты и основания условно делятся на два класса: жёсткие и мягкие кислоты и основания. При оценке жёсткости и мягкости кислот и оснований учитывается их химический состав, электронное строение и сравнительная устойчивость образуемых ими кислотно-основных комплексов. Согласно принципу жёстких и мягких кислот и оснований кислотно-основные взаимодействия протекают таким образом, что жёсткие кислоты предпочтительно связываются с жёсткими основаниями, а мягкие кислоты – с мягкими основаниями. Примеры жёстких и мягких кислот и оснований приведены в табл. 5 и 6:
Таблица 5. Классификация кислот Льюиса
| Жёсткие | Промежу- Точные | Мягкие | |
| Кислоты Льюиса (комплексо- образова- тели) | H+,Li+,Na+, K+,Mg2+,Ca2+, Al3+,Mn2+,Cr3+, Fe3+,Co3+,Zr4+, BF3,AlCl3, HHal,CO2, NC+ | Fe2+,Co2+,Ni2+, Cu2+,Zn2+,Ru2+, Rh3+,Ir3+,SO2, NO+,R3C+,C6H5 | Cu+,Ag+,Au+, Au3+,Hg2+, Pb2+,Bi3+,Cd2+, Pt2+,Pt4+,Cr, Fe,I2,I+,Br+, Br2, RO+, CH3Hg, R+, алкены, хиноны |
Таблица 6. Классификация оснований Льюиса
| Жёсткие | Промежу-точные | Мягкие | |
| Основания Льюиса (донорные атомы лигандов) | F-,OH-,O2-H2O,CO32-, PO43-,SO42-, NO3-,NH3, N2H4,RNH2, CH3COO- ROH,RO-, R2O | C5H5N | R2S,R3P, R3As,CO, RNC |
Применительно к комплексообразованию мягкость кислоты или основания Льюиса означает его склонность к образованию связей преимущественно ковалентного, а жёсткость – преимущественно ионного характера. Типичные жёсткие кислоты (катионы – комплесообразователи) имеют малый атомный или ионный радиус, высокую электроотрицательность, с трудом поляризуются (Н+,Mn2+,Cr3+,Fe3+,Co3+) и трудно восстанавливаются.
Наиболее жёсткие катионы имеют электронную структуру инертного газа и не имеют вакантных энергетически низко расположенных d-орбиталей. Катионы с частично заполненными
d-орбиталями занимают промежуточное положение. При прочих равных условиях жёсткость катиона возрастает с увеличением его заряда. Так, Fe3+ является более жёсткой кислотой Льюиса, чем Fe2+.
Лиганды с высокоотрицательными донорными атомами являются жёсткими основаниями (H2O,OH-,NH3,Cl-), тогда как поляризуемые лиганды – мягкие основания (SCN-, CN-, RS-,RSH).
Мягкие кислоты имеют большие размеры и легко поляризуются (Ag+,Pd2+,Pt2+,Pt4+,Cd2+).Мягкие кислоты Льюиса имеют электроны на d-орбиталях, способные к образованию p-связей в результате перекрывания с вакантными d-орбиталями мягких лигандов. Наиболее устойчивые комплексы образуются между жёсткой кислотой и жёстким основанием или мягкой кислотой и мягким основанием.
Поскольку реакции комплексообразования подразумевают взаимодействие кислот и оснований Льюиса, с увеличением основных свойств лигандов устойчивость комплексов повышается.
Например, среди однотипных соединений: [Ag(NH3)2]+ (β2=1,5×107) и [Ag(CN)2]- (β2=1×1021) более стойким является второе.
Прочность связи между лигандами и ионами-комплексообразователями зависит не только от их природы, но и от природы лиганда, находящегося в транс- положении к первому. Это явление носит название транс -эффекта. Он возрастает в ряду лигандов: H2O<OH-< NH3< Cl-< Br-< I-< NO2-<CO <CN-.
Чем выше транс -активность лиганда, тем менее прочна связь с комплексообразователем его транс -партнёра, и тем легче последний замещается другими лигандами.
Так, в соединении
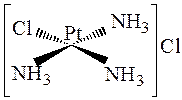
молекула аммиака, расположенная по одной диагонали с хлором, более подвижна, чем две другие молекулы его. Взаимодействие такого соединения с соляной кислотой приводит к образованию только транс -изомера:

Аналогично, в соединении
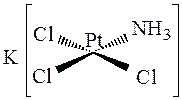
ионы хлора, лежащие на координате хлор-платина-хлор, более подвижны, чем ионы, транс -партнёром которых является аммиак. Поэтому реакция замещения ионов хлора аммиаком происходит с образованием цис-изомера:
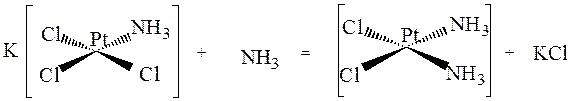
Во всех случаях происходит в первую очередь замещение того лиганда, транс- партнёр которого наиболее активен.Замещение молекулами воды молекул аммиака из внутренней сферы соединения
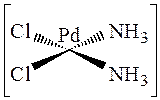
происходит медленнее, чем из соединения
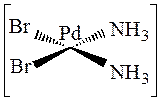 ,
,
так как бром транс -активнее, чем хлор, и аммиак в транс -положении к брому более подвижен, чем в качестве транс -партнёра к хлору.
В комплексных соединениях Co3+ группа NO2- проявляет большее транс -влияние, чем группа CNS-. Поэтому при реакции между NH4[Co(NO2)4(NH3)2] и NH4CNS происходит замещение только двух групп NO2- на группы CNS-:
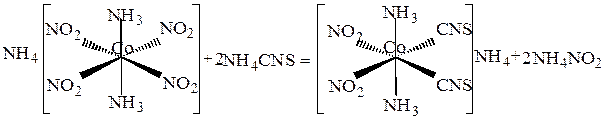
Применение избытка роданида аммония не вызывает дальнейшего замещения групп NO2- в комплексе, так как группы CNS- более подвижны. В то же время благодаря большей транс -активности групп NO2- легко происходит обратный процесс:

Транс-активность лигандов влияет и на кислотные свойства комплекса. Чем выше транс-активность заместителя, расположенного по одной диагонали с водородсодержащим лигандом, тем меньше способность последнего к отщеплению протона, т.е. слабее выражены кислотные свойства комплекса. Поэтому молекула воды, стоящая в транс -положении к другой молекуле воды, обычно обладает более выраженными кислотными свойствами, чем молекула воды, транс -партнёром которой являются более транс -активные лиганды(Cl-,Br-,OH-,NO2-,NH3). Например, транс -изомер диаквадиамминплатины проявляет более сильные кислотные свойства, чем цис -изомер.

Транс - партнёром воды в случае транс -изомера является вода, а в случае цис -изомера –аммиак.рК2 для транс -изомера значительно выше, чем рК1, так как во второй стадии реакции транс -партнёром воды является транс -активный ОН. В результате кислотность во второй стадии выше. Для цис -изомера небольшое отличие рК2 от рК1 обусловлено тем, что заряд катиона[Pt(NH3)2(H2O)2]+меньше, чем катиона [Pt(NH3)2(H2O)]2+.
3.4.2. Хелатный эффект
Комплексы хелатообразующих реагентов по сравнению с комплексами их монодентатных аналогов обладают повышенной устойчивостью (так называемый хелатный эффект). Например, комплексы этилендиамина устойчивее, чем аммиака, причём устойчивость хелатного цикла зависит от числа атомов в нём; наиболее устойчивы пяти – и шестичленные циклы. Так, для [Cd(NH3)4]2+ константа устойчивости β4=3,63×106,а этилендиаминового комплекса кадмия почти в 106 раз больше- β4=1,91×1012. Объясняется это тем, что при координации этилендиамина
NН2-CH2-CH2-NH2 во внутренней сфере образуется пятичленный цикл. Мерой хелатного эффекта обычно служит разность общих констант устойчивости хелатного комплекса и его нециклического аналога Δlgβ. При этом монодентатный и полидентатный лиганды должны иметь одинаковые донорные атомы и по возможности близкую структуру, а комплексы – иметь одинаковое число донорных атомов и геометрию внутренней координационной сферы. Величины хелатного эффекта для некоторых комплексов приведены в табл.7.
Таблица 7. Хелатный эффект для комплексов некоторых
полиаминов Δlgβ (N – дентатность лигандов)
| Ион | en N = 2 | den N = 3 | trien N = 4 | tren N = 4 | penten N = 6 |
| Δlgβ | Δlgβ | Δlgβ | Δlgβ | Δlgβ | |
| Co(II) | 2,4 | 3,7 | 5,7 | 7,5 | 10,5 |
| Ni(II) | 2,9 | 4,3 | 6,2 | 7,0 | 10,8 |
| Cu(II) | 3,4 | 6,0 | 7,8 | 6,2 | - |
| Zn(II) | 1,8 | 2,2 | 3,0 | 5,5 | - |
| Cd(II) | 1,2 | 2,7 | 3,8 | 5,4 | 11,9 |
В табл.7 указаны следующие полиамины:en- H2N-CH2-CH2-NH2,
den - H2N-CH2-CH2-NH-CH2-CH2-NH2, tren - N(CH2-CH2-NH2)3,
trien - H2N-CH2-CH2-NH-CH2-CH2-NH-CH2-CH2-NH2,
penten - [CH2-N(CH2-CH2-NH2)2]2.
Величина Δlgβ положительна, если стандартная свободная энергия комплексообразования ΔGо < 0. На практике хелатный эффект имеет как энтальпийную, так и энтропийную составляющие. В самом первом приближении изменение энтропии при химической реакции определяется изменением числа частиц. При этом увеличение числа частиц означает увеличение энтропии. Для монодентатного лиганда изменение суммарного числа частиц в растворе в результате комплексообразования не происходит: [Zn(Н2O)4]2+ + 4NH3 D [Zn(NH3)4]2+ + 4H2O.
Поэтому можно считать, что приблизительно ΔSр-ции = 0.
Если лиганд полидентатный, то суммарное число частиц в ходе реакции увеличивается, и в этом случае ΔSр-ции > 0:
[Zn(OH2)4]2+ + 2NH2(CH2)2NH2 D [Zn(NH2(CH2)2NH2)2]2+ + 4H2O.
Но эти рассуждения можно считать достаточно приблизительными, так как не учитываются: сольватация комплекса, размер цикла и что образующаяся при комплексообразовании вода не остаётся в свободном виде и включается в общую, достаточно упорядоченную структуру воды. Однако увеличение энтропии комплексообразования при переходе от монодентатных к аналогично построенным полидентатным лигандам наблюдается почти всегда (табл.8):
Таблица 8. Константы устойчивости и термодинамические параметры комплексов кадмия(II) с аминами при 25оС
| Комплекс | lgβn | ΔHo кДж/моль | ΔSo Дж/моль·К | ΔGo кДж/моль |
| [Cd(NH3)2]2+ | 4,95 | -29,79 | -5,19 | -28,24 |
| [Cd(NH2CH3)2]2+ | 4,81 | -29,37 | -6,46 | -27,45 |
| [Cd(N2H4C2H4)]2+ | 5,84 | -29,41 | 13,05 | -33,30 |
| [Cd(NH3)4]2+ | 7,44 | -53,14 | -35,50 | -42,51 |
| [Cd(NH2CH3)4]2+ | 6,55 | -57,32 | -66,94 | -37,41 |
| Cd(N2H4C2H4)2]2+ | 10,62 | -56,48 | 13,75 | -60,67 |
В соотвествии с правилом Чугаева наиболее устойчивыми являются пяти- и шестичленные хелатные циклы, и наибольший выигрыш энтропии наблюдается именно у них. Особенно значителен энтропийный эффект, если при образовании комплекса замыкается несколько циклов. Так, комплексы металлов с ЭДТА содержат пять хелатных циклов и поэтому исключительно устойчивы.
Изменение стандартной энтальпии системы в результате комплексообразования: ΔНо = ΔНо1 + ΔНо2.
ΔНо1 характеризует энергию образования координационных связей центрального атома с донорными атомами лиганда. ΔНо2 характеризует изменение энергии лигандов в результате комплексообразования. ΔНо1 < 0, поскольку образование связей металл – лиганд энергетически выгодно. ΔНо2 > 0, так как ориентация лигандов вокруг центрального атома и связанное с ней их взаимное отталкивание, деформация лигандов и пр. требуют затраты энергии. Если монодентатный и полидентатный лиганды достаточно близки по своей природе, то в первом приближении можно считать, что энергия образования связей для нециклического и хелатного комплексов равны ΔНо1 нецикл = ΔНо1 цикл. Но соответствующие стерические составляющие ΔНо2 нецикл и ΔНо2 цикл могут различаться. Одной из причин этого различия является то обстоятельство, что для ориентации монодентатных лигандов вокруг центрального атома надо затратить больше энергии, чем для ориентации полидентатных лигандов, поскольку в полидентатном лиганде его функциональные группы уже ориентированы друг относительно друга. Таким образом ΔНо2 нецикл > ΔНо2 цикл, и,
следовательно, в итоге ΔНоцикл - ΔНонецикл < 0.
При образовании связей металл – лиганд почти всегда происходит искажение углов связей в молекуле лиганда. Этот эффект препятствует образованию хелатного комплекса, но в случае пя-ти- и шестичленных циклов искажения структуры лигандов обычно минимальны. Таким образом, пяти- и шестичленный циклы являются наиболее благоприятны и с точки зрения энтропийной, и энтальпийной составляющей. Но, как видно из табл.8 для комплексов кадмия с монодентатными и бидентатным(этилендиамин) лигандами различия в величинах ΔНо весьма невелики, а ΔSo- значительны, т.е. основной вклад в хелатный эффект, как правило, вносит энтропийный фактор.
3.4.3. Стерические факторы
Чем меньше радиус иона-комплексообразователя, и чем выше его заряд, тем более прочные комплексы он образует. Так, для [Co(NH3)6]2+ lgβ6 =4,39, а для [Co(NH3)6]3+ lgβ6=35,21.
Комплексный ион [Co(NH3)6]2+ обратимо распадается в воде:
[Co(NH3)6]2+ + 6H2O D [Co(H2O)6]2+ + 6NH3.В то же время комплексный ион [Co(NH3)6]3+ практически не разрушается водой.
Устойчивость комплексных соединений также зависит от пространственного окружения донорных атомов. Введение заместителей в положения, близкие к донорным атомам, может затруднить образование комплекса. Особенно сильно проявляются стерические затруднения в комплексах с хелатообразующими лигандами. Например, такой эффект наблюдается при использовании 2-алкилпроизводных 8-оксихинолина(HL):
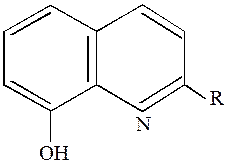
Он может образовывать с двухзарядными ионами внутрикомплексные соединения тетраэдрической конфигурации состава МL2,а с трёхзарядными - октаэдрические комплексы МL3. Однако для ионов малого радиуса, в частности Al3+, образование комплексов ML3 невозможно ввиду стерических затруднений, создаваемых группой в положении 2. В этом случае образуются лишь заряженные, растворимые комплексы ML2+и ML2+. На этом основано применение в аналитической химии 2-замещённых
8-оксихинолинов для осаждения ионов Cr3+,Fe3+,Zn2+ в присутствии Al3+.
Пространственные затруднения возникают и при образовании комплексов с вынужденной конфигурацией. Так, линейный триэтилентетрамин образует с ионами Cu2+ более устойчивый хелат, чем разветвлённый:
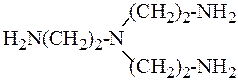
В первом случае возможна более благоприятная для Cu2+ плоская квадратная конфигурация, во втором требуется не характерная для Cu2+ тетраэдричекая структура. Для Zn2+, наоборот, предпочтительнее тетраэдрическая конфигурация, поэтому с разветвлённым амином комплекс Zn2+ более устойчив.
3.5. Кинетика и механизм реакций обмена лигандов
В общем случае реакции замещения лигандов по своему характеру нуклеофильные, так как замещаемый лиганд уносит электронную пару, ранее образовывавшую σ-связь металл-лиганд, а замещающий лиганд приносит пару электронов и поэтому занимает положение с низкой электронной плотностью. По аналогии с органическими соединениями эти процессы обозначаются как SN-процессы (нуклеофильное замещение). Возможны два основных пути протекания реакции в зависимости от того, происходит ли предварительная диссоциация реагирующего комплекса (мономолекулярный процесс SN1):
медленная
M-X = M+X
быстрая
M +Y → MY
Или важной стадией является бимолекулярный процесс замещения SN2, скорость которого зависит от концентрации как комплекса, так и замещающего лиганда:
медленная быстрая
M-X + Y = MXY → MY + X
Следовательно, SN1- механизм должен привести к активированному комплексу, в котором ион металла имеет меньшее координационное число, чем в исходном комплексе, тогда как SN2 –механизм требует увеличения числа присоединённых лигандов в переходном состоянии.
Необходимо далее рассмотреть разность энергии между реагирующим комплексом и этими переходными состояниями. Если в комплексе нет π–связей металл-лиганд, то величину скорости можно предсказать, предполагая электростатическое взаимодействие между ионами металла и лигандами. Это положение иллюстрирует табл.9.
Таблица 9. Влияние изменения заряда и размера
|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 78; Нарушение авторских прав?; Мы поможем в написании вашей работы!