
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способы выражения концентраций растворов
|
|
|
|
Введение
Данное пособие предназначено для студентов I курса фармацевтического факультета заочной формы обучения.
Методические указания по курсу общей и неорганической химии включают краткие теоретические сведения практически по всем разделам общей химии, типовые задачи с решениями, контрольные вопросы по всему курсу и таблицу контрольных заданий.
Основная цель пособия – обеспечить понимание студентами фундаментальных понятий и законов химии, сформировать основные расчетные навыки, помочь оценить и усвоить тот уровень знаний, который будет им необходим при изучении курсов аналитической, органической, физической химии, а также в практической деятельности.
1.1. Молярная концентрация (с(Х)) – количество вещества (Х), содержащегося в 1 дм3 раствора.
с(Х) = 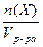 =
= 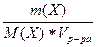
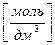
Допускаемые обозначения: 1М HCl – c(HCl) = 1 моль/дм3
0,1МHCl – c(HCl) = 0,1 моль/дм3 – децимолярный раствор;
0,01МHCl – c(HCl) = 0,01 моль/дм3 – сантимолярный раствор.
1.2. Эквивалент вещества Х(f эк(Х)) – условная или реальная частица, эквивалентная одному протону в обменных реакциях или одному электрону в окислительно-восстановительных реакциях.
Фактор эквивалентности (f эк(Х)) – доля реальной частицы, соответствующей эквиваленту.
Пример: определите f эк(Х) для соединений а) H2SO4 (в условиях полного и частичного обмена протонов); б) Al(OH)3 (в условиях полного и частичного обмена анионов гидроксила); в) Fe2(SO4)3.
Решение:
а) H2SO4 + 2KOH ® K2SO4 + H2O (f эк(H2SO4) =  )
)
H2SO4 + KOH ® KНSO4 + H2O (f эк(H2SO4) = 1)
б) Al(OH)3 + 3HCl ® AlCl3 + 3H2O (f эк(Al(OH)3) =  )
)
Al(OH)3 + 2HCl ® AlOHCl2 + 2H2O (f эк(Al(OH)3) =  )
)
Al(OH)3 + HCl ® Al(OH)2Cl + H2O (f эк(Al(OH)3) = 1)
в) f эк(Fe2(SO4)3) = 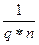 =
= 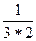 =
= 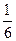 , где
, где
q – заряд катиона металла;
n – число катионов металла в формуле соли.
|
|
|
Соответственно,
М(f эк(Х)Х) = f эк(Х)*М(Х)
n(f эк(Х)Х) = 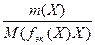
Молярная концентрация эквивалента вещества (Х) (с(f эк(Х)Х) – количество вещества эквивалента, содержащегося в 1дм3 раствора:
с(f эк (Х)Х) = 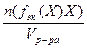 ;
; 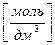
Допускаемые обозначения:
1н H2SO4 – с( H2SO4) = 1 моль/дм3
H2SO4) = 1 моль/дм3
0,1н H2SO4 – с( H2SO4) = 0,1 моль/дм3 (децинормальный)
H2SO4) = 0,1 моль/дм3 (децинормальный)
0,01н H2SO4 – с( H2SO4) = 0,01 моль/дм3 (сантинормальный)
H2SO4) = 0,01 моль/дм3 (сантинормальный)
1.3. Моляльность (сm(X)) – количество вещества (Х), содержащегося в 1 кг растворителя.
сm(Х) = 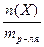
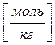
1.4. Массовая доля растворенного вещества (w) – масса вещества (Х), содержащегося в 100 г раствора.
w = 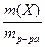
Допускается выражать массовую долю в долях единицах, в процентах (%), промилле (%о – тысячная часть), в миллионных долях (млн–1).
1.5. Титр раствора (Т(Х)) – масса вещества (Х), содержащегося в 1 мл раствора.
Т(Х) = 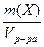

1.6. Молярная доля вещества (c) – отношение количества вещества компонента (Х) к общему количеству вещества системы.
c(Х) = 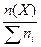
Пример: В 100 мл раствора содержится 12 г CaCl2 (пл. 1,074 г/мл). Определите: а) с(СаCl2); б) с( СаCl2); в) сm(СаCl2); г) Т(СаCl2); д) w(СаCl2).
СаCl2); в) сm(СаCl2); г) Т(СаCl2); д) w(СаCl2).
Решение:
а) с(СаCl2) = 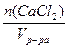 =
= 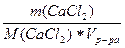 =
= 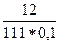 = 1,081 моль/л;
= 1,081 моль/л;
б) с( СаCl2)=
СаCl2)=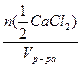 =
=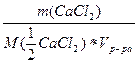 =
=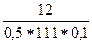 =2,162 моль/л;
=2,162 моль/л;
в) m(H2O)=mр-ра – m(СaСl2) = r*Vр-ра – m(СaСl2) =
1,074 г/мл * 100 мл – 12 г = = 95,4 г
сm(СаCl2) = 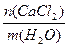 =
= 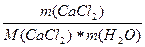 =
= 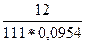 =
=
1,133 моль/кг
г) Т(СаCl2) = 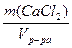 =
= 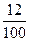 = 0,12 г/мл
= 0,12 г/мл
д) w(СаCl2) = 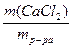 =
= 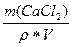 =
= 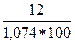 = 0,1117 (11,17%)
= 0,1117 (11,17%)
Между различными способами выражения концентрации существует взаимосвязь:
1) w(Х) = 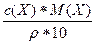 =
= 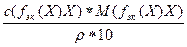 =
= 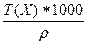
2) с(Х) = 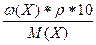 = с(f эк(Х)Х) * f эк(Х) =
= с(f эк(Х)Х) * f эк(Х) = 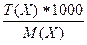
3) с(f эк(Х)Х) = 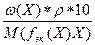 =
= 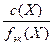 =
= 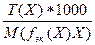
4) сm(X) = 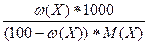
5) Т = 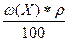 =
= 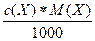 =
= 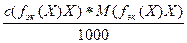
Пример: Плотность раствора с w%(H2SO4) = 15% равна r = 1,105 г/мл. Определите: а) с(H2SO4); б) с(1/2H2SO4); в) сm(H2SO4); г) Т(H2SO4).
Решение:
а) с(H2SO4) = 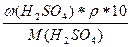 =
= 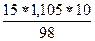 = 1,69 моль/л
= 1,69 моль/л
б) с(1/2H2SO4) = 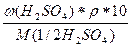 =
= 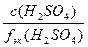 = 3,38 моль/л
= 3,38 моль/л
в) сm(H2SO4) = 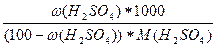 =
= 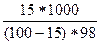 = 1,8 моль/кг
= 1,8 моль/кг
г) Т(H2SO4) = 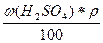 =
= 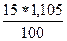 = 0,1658 г/мл
= 0,1658 г/мл
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 652; Нарушение авторских прав?; Мы поможем в написании вашей работы!