
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основы химической кинетики. Химическое равновесие
|
|
|
|
Основы количественных расчетов в химии. Закон эквивалентов.
Закон эквивалентов: количество вещества эквивалентов всех участвующих в реакции веществ равны.
Для реакции: аА + вВ = сС + dD
n(f эк(А)А) = n(f эк(В)В) = n(f эк(С)С) = n(f эк(D)D) или
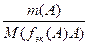 =
= 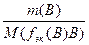 =
= 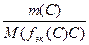 =
= 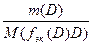
Если реагирующие вещества взяты в виде растворов, то
с(f эк(А)А)*V(A) = с(f эк(В)В)*V(В)
Пример: Рассчитайте массу серной кислоты, достаточной для нейтрализации 41,6 г Са(ОН)2.
Решение: Са(ОН)2 + H2SO4 ® CaSO4 + 2H2O
n( Ca(OH)2) = n(
Ca(OH)2) = n( H2SO4)
H2SO4)
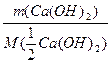 =
= 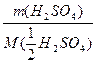
m(H2SO4) = 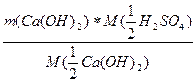 =
= 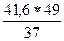 = 55,1 г
= 55,1 г
Пример: Рассчитайте молярную концентрацию эквивалента фосфорной кислоты, если на нейтрализацию 20 мл ее раствора было израсходовано 15 мл 0.1н раствора КОН.
Решение: Н3РО4 + 3КОН ® К3РО4 + 3Н2О
с( Н3РО4)*V(Н3РО4) = с(КОН)*V(КОН)
Н3РО4)*V(Н3РО4) = с(КОН)*V(КОН)
с( Н3РО4) =
Н3РО4) = 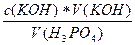 =
=  = 0,075 моль/л
= 0,075 моль/л
4.1. Скорость химической реакции.
Скорость химической реакции определяется изменением количества вещества, вступающего в реакцию или образующегося в результате реакции в единицу времени в единице объема системы (для гомогенной реакции) или на единице площади поверхности раздела фаз (для гетерогенной реакции)
V = 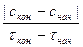 =
= 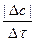

На скорость химических реакций влияют: концентрация, температура, природа реагирующих веществ, катализатор, величина поверхности твердого реагента и т.д.
Закон действия масс (ЗДМ):
Скорость простой гомогенной реакции при постоянной температуре пропорциональна произведению концентраций реагирующих веществ в степенях, равных их стехиометрическим коэффициентам
аА + вВ = сС + dD
V = kС *С
*С , где k – константа скорости реакции.
, где k – константа скорости реакции.
k не зависит от концентраций, но зависит от химической природы реагирующих веществ, температуры и катализатора.
Пример: Напишите кинетическое выражение для реакций:
|
|
|
а) 2NOгаз + Cl2 газ = 2NOCl газ
б) Fe2O3 к + 3Н2 газ 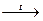 2Feк + 3Н2Огаз
2Feк + 3Н2Огаз
Как изменится скорость химической реакции, если уменьшить объем реакционного сосуда в 3 раза?
Решение:
а) 2NOг + Cl2 г = 2NOCl г
Vнач = k*с2(NO)*c(Cl2) или Vнач = kp2(NO)p(Cl2)
При уменьшении объема сосуда концентрация и давление каждого компонента возрастет в 3 раза: Vкон. = k(3c(NO))23c(Cl2) = 27Vнач.
Скорость химической реакции возрастет в 27 раз.
б) Fe2O3 к + 3Н2 газ = 2Feк + 3Н2Огаз
так как Fe2O3 – твердое вещество, концентрация которого не изменяется в ходе реакции, то Vнач = k*с3(Н2); Vкон = k(3c(H2))3 = 27kc3(H2) = 27Vнач.
Скорость химической реакции возрастет в 27 раз.
Пример: Во сколько раз следует увеличить давление, чтобы скорость образования NO2 по реакции 2NO + O2 = 2NO2 возросла в 1000 раз?
Решение: Vнач = k*с2(NO)*c(O2)
Vкон = k(xc(NO))2*xc(O2) = x3kc2(NO)*c(O2) = x3Vнач
 =
= 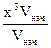 = 1000; х =
= 1000; х = 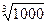 = 10
= 10
Давление следует увеличить в 10 раз.
Эмпирическое правило Вант-Гоффа показывает, что при повышении температуры на 10о скорость реакции возрастает в 2-4 раза
 =
= 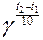 , где
, где
g – температурный коэффициент, показывающий во сколько раз увеличится скорость реакции при повышении температуры на 10о.
Пример: Во сколько раз увеличится скорость химической реакции при повышении температуры на 40оС, если g = 3?
Решение:  =
= 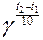 = 34 = 81
= 34 = 81
Увеличится в 81 раз.
Увеличение скорости реакции при повышении температуры объясняется увеличением числа столкновений активных молекул, т.е. молекул, обладающих необходимой энергией (Еа).
Зависимость константы скорости реакции (k) от энергии активации (Еа) выражается уравнением Аррениуса:
k = A*e  , где
, где
k – константа скорости реакции при температуре Т;
А – предэкспоненциальный коэффициент, учитывающий частоту столкновения частиц;
Еа – энергия активации реакции, Дж/моль;
R – 8,31 Дж/моль*К.
Из этого уравнения следует, что чем больше энергия активации, тем меньше будут константа и скорость химической реакции.
Определив константы скорости реакций при двух разных температурах, можно рассчитать величину Еа:
|
|
|
Еа = 2,3R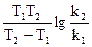
Пример: Константа скорости разложения оксида азота(V) равна при 35оС 8,76*10–3 мин–1, а при 45оС – 2,99*10–2 мин–1. Вычислите энергию активации в указанном интервале температур.
Решение: Еа = 2,3R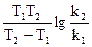
Еа = 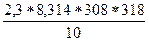 lg
lg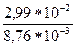 = 99857 Дж/моль
= 99857 Дж/моль
Катализатор увеличивает скорость химических реакций за счет уменьшения энергии активации.
Пример: Энергия активации некоторой реакции в отсутствие катализатора равна 98 кДж/моль, а с катализатором – 50 кДж/моль. Во сколько раз возрастет скорость реакции в присутствии катализатора (t = 25oC)?
Решение:
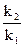 =
=  = e
= e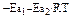
lg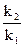 =
=  =
= 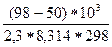 = 8,423
= 8,423
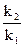 = 108,423 = 2,65*104
= 108,423 = 2,65*104
Снижение энергии активации на 48 кДж/моль приведет к увеличению скорости реакции в 2,65*104 раз.
4.2. Химическое равновесие.
Признаки химического равновесия:
а) равенство скоростей прямой и обратной реакций;
б) постоянство концентраций компонентов системы во времени;
в) динамический характер;
г) отсутствие макроизменений во времени;
д) катализатор не влияет на состояние равновесия, он только ускоряет его наступление.
аА + вВ Û сС + dD
 =
=  [A]a[B]в
[A]a[B]в  =
= 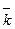 [С]с[D]d
[С]с[D]d
т.к.  =
=  , то
, то  [A]a[B]в =
[A]a[B]в = 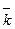 [С]с[D]d
[С]с[D]d
Кравн = 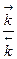 =
= 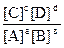 , например,
, например,
N2 + 3H2 Û 2NH3
Кравн = 
Величина Кравн зависит от температуры, природы реагирующих веществ, но не зависит от их концентрации.
Принцип Ле Шателье:
Если находящуюся в равновесии систему подвергнуть внешнему воздействию (изменить температуру, концентрацию, внешнее давление), то в системе происходят изменения, уменьшающие внешнее воздействие.
Пример: В какую сторону сместится равновесие в системе
N2 + 3H2 Û 2NH3 DH = –92 кДж/моль при: а) увеличении давления;
б) уменьшении концентрации Н2; в) понижении температуры.
Решение:
а) давление, оказываемое 2 моль NH3, меньше давления, оказываемого
4 моль газа (1 моль N2 + 3 моль Н2), поэтому согласно принципу
Ле-Шателье увеличение давления в системе приведет к смещению равновесия вправо;
б) увеличение концентрации Н2 приведет к возрастанию скорости того процесса, в котором происходит связывание водорода, т.е. скорости прямой реакции. Следовательно, равновесие сместится вправо;
в) реакция экзотермическая, сопровождается выделением тепла и повышением температуры окружающей среды, следовательно, понижении температуры вызовет смещение равновесия вправо, в соответствии с принципом Ле Шателье.
|
|
|
Пример: При некоторой температуре равновесие в системе
2NO2 Û 2NO + O2 установилось при следующих концентрациях:
[NO2] = 0,006 моль/л, [NO] = 0,024 моль/л. Определите константу равновесия и исходную концентрацию NО2
Решение:
[O2] =  [NO] = 0,012 моль/л
[NO] = 0,012 моль/л
К = 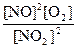 =
=  = 0,192
= 0,192
Концентрация разложившегося в результате реакции NO2 равна:
с(NO2) = [NO] = 2[O2] = 0,024 моль/л
сисх (NO2) = [NO2] + c(NO2) = 0,006 + 0,024 = 0,03 моль/л
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 2485; Нарушение авторских прав?; Мы поможем в написании вашей работы!