
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
План лекции. Основы атомно-молекулярного учения
|
|
|
|
Основы атомно-молекулярного учения
Лекция №2
Химические свойства солей
Способы получения солей
1. Взаимодействие металла с неметаллами:
Zn + Cl2 = ZnCl2
Cu + S = CuS
2. Взаимодействие металлов с кислотами:
Mg + 2HCl = MgCl2 + H2
Fe + H2SO4(p) = FeSO4 + H2
Cu + 4HNO3(к) = Cu(NO3)2 + 2NO2 +2H2O
3. Взаимодействие амфотерных металлов со щелочами:
Zn + 2NaOH = Na2ZnO2 + H2 при сплавлении
2Al + 6NaOH = 2Na3AlO3 + 3H2 при сплавлении
4. Взаимодействие металлов с солями:
CuSO4 + Fe = FeSO4 + Cu
5. Взаимодействие основных оксидов с кислотами:
MgO + H2SO4 = MgSO4 + H2O
Na2O + 2HNO3 = 2NaNO3 + H2O
6. Взаимодействие кислотных оксидов с гидроксидами, растворимыми в воде:
СО2 + Са(ОН)2 = СаСО3¯ + Н2О
N2O5 + 2KOH = 2KNO3 + H2O
7. Взаимодействие кислот с гидроксидами:
KOH + HNO3 = KNO3 + H2O
8. Взаимодействие основных оксидов с кислотами:
MgO + H2SO4 = MgSO4 + H2O
9. Взаимодействие двух различных солей:
AgNO3 + NaCl = AgCl¯ + NaNO3
Ba(NO3)2 + Na2SO4 = BaSO4¯ + 2NaNO3
10. Взаимодействие солей с кислотами:
2NaCl + H2SO4 = Na2SO4 + 2HCl
Взаимодействие металлов с солями:
CuSO4 + 2Al = Al2(SO4)3 + 3Cu
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
1. Взаимодействие солей с гидроксидами, растворимыми в воде с образованием новой соли и нового гидроксида:
Fe(NO3)3 + 3NaOH = Fe(OH)3¯ + 3NaNO3
ZnSO4 + 2KOH = Zn(OH)2¯ + K2SO4
2. Взаимодействие солей с кислотами:
2NaCl + H2SO4 = Na2SO4 + 2HCl
CuSO4 + H2S = CuS¯ + H2SO4
3. Взаимодействие солей друг с другом:
CaCl2 + K2CO3 = CaCO3¯ + 2KCl
Соли представляют собой твердые кристаллические вещества. По своей растворимости в воде соли делятся на легкорастворимые (NaCl, KCl, CaCl2), труднорастворимые (PbCl2, CaS, Ag2SO4) и нерастворимые (BaSO4, BaCO3, CaSiO3).
Литература:
1. Новиков Г.И. Основы общей химии. -М.: Высшая школа, 1988.
2. Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия.- М.: Химия, 1992.
1. Основные химические понятия.
2. Основные законы химии.
|
|
|
Химия – это наука о превращениях веществ. Она изучает состав и строение веществ, зависимость свойств веществ от их состава и строения, условия и пути превращения одних веществ в другие.
Химический элемент – это совокупность атомов с одинаковым зарядом ядра, равным порядковому номеру элемента в периодической системе элементов.
Атом – наименьшая частица химического элемента, обладающая его химическими свойствами.
Молекула – наименьшая частица вещества, обладающая его химическими свойствами и состоящая из соединенных между собой атомов.
Ион – электрически заряженная частица, которая образуется при отдаче или приобретении электронов атомами или молекулой.
Атомная единица массы (а.е.м.) – это 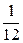 часть массы атома изотопа углерода – 12С.
часть массы атома изотопа углерода – 12С.
Масса атома углерода 12С равна 1,993×10–26 кг, следовательно, 1 а.е.м. = 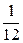 ×1,993×10–26 кг = 1,6608×10–27 кг.
×1,993×10–26 кг = 1,6608×10–27 кг.
Относительная атомная масса (Аг) элемента – это число, показывающее во сколько раз абсолютная масса одного атома данного элемента больше атомной единицы массы.
Относительная молекулярная масса (Мг) – химического соединения – это число, показывающее, во сколько раз абсолютная масса одной молекулы этого соединения больше атомной единицы массы.
Моль (п) – это количество вещества, содержащее столько же структурных единиц (атомов, молекул, ионов, электронов), сколько их содержится в 12 г изотопа углерода 12С.
Число структурных единиц, содержащихся в одном моле любого вещества, называют постоянной Авогадро (NA):
NA = 6,02×1023 моль–1.
Молярная масса вещества (М) – это масса одного моля вещества. Единица измерения в СИ (г/моль, кг/моль). Молярная масса вещества численно равна относительной молекулярной массе данного вещества.
Молярный объем (Vm) – это объем, который занимает 1 моль любого газообразного вещества при нормальных условиях. Единица измерения в СИ м3/моль, л/моль.
|
|
|
Валентность элемента – это способность его атомов соединяться с другими атомами в определенных отношениях.
|
|
|
|
|
Дата добавления: 2014-11-09; Просмотров: 471; Нарушение авторских прав?; Мы поможем в написании вашей работы!