
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Неметаллы
|
|
|
|
СОЛИ
Соли представляют собой продукты замещения атомов водорода в кислоте на металл или группы ОН- в основании на кислотный остаток.
В зависимости от степени замещения иона водорода в кислотах или ОН- группы в основаниях образующиеся соли классифицируют на кислые (гидросоли) типа NaHSO4, Mg(HCO3)2, средние (полное замещение Н и ОН) типа Fe2(SO4)3, Na2CO3 и основные (гидроксосоли) типа Fe(OH)Cl, (CuOH)2CO3.
Двойные соли состоят из ионов двух разных металлов и кислотного остатка. Диссоциируют они на те ионы, из которых они состоят:
KAl(SO4)2 ↔ K+ + Al3+ + 2SO42- (NH4)2Fe(SO4)2 ↔ 2NH4+ + Fe2+ + 2SO42-
В состав комплексных солей входят сложные (комплексные) ионы, которые и отщепляются при диссоциации:
K4[Fe(CN)6]↔4K+ + [Fe(CN)6]4- [Ag(NH3)2]Cl↔[Ag(NH3)2]+ +Cl-
Комплексные ионы в очень малой степени подвергаются дальнейшей диссоциации:
[Fe(CN)6]4-↔Fe2+ + 6CN- [Ag(NH3)2]+ ↔ Ag+ + 2NH3
Таким образом, комплексные соли при диссоциации сначала отщепляют комплексные ионы, которые затем подвергаются вторичной диссоциации как слабые электролиты.
Название солей. Названия солей по международной номенклатуре состоят из двух слов: названия аниона в именительном падеже и катиона – в родительном падеже. Если один и тот же металл проявляет различную степень окисления, то её указывают в скобках римской цифрой, например: Fe2(SO4)3 сульфат железа (III), FeSO4 – сульфат железа (II).
Названия кислых солей образуют добавлением к аниону приставки гидро-: например, NaHSO4 – гидросульфат натрия, KH2PO4 – дигидрофосфат калия.
Названия основных солей образуют, добавляя к наименованию аниона соответствующей средней соли приставки гидроксо-: Al(OH)SO4 – гидроксосульфат алюминия, Al(OH)2Cl – дигидроксохлорид алюминия.
Получение. Соли получают при химическом взаимодействии соединений различных классов и простых веществ.
|
|
|
1. Реакция нейтрализации:
KOH + HNO3 = KNO3 + H2O
OH- + H+ = H2O
2. Взаимодействие кислот с основными оксидами:
H2SO4 + CuO = CuSO4 + H2O
2H+ + CuO = Cu2+ + H2O
3. Взаимодействие кислот с солями:
H2S + CuCl2 = CuS↓ + 2HCl
H2S + Cu2+ = CuS↓ + 2H+
4. Взаимодействие двух различных солей:
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
SO42- + Ba2+ = BaSO4↓
5. Взаимодействие оснований с кислотными оксидами:
Ca(OH)2 + CO2 = CaCO3↓ + H2O
Ca2+ + 2OH- + CO2 = CaCO3↓ + H2O
6. Взаимодействие щелочей с солями:
3KOH + FeCl3 = 3KCl + Fe(OH)3↓
3OH- + Fe3+ = Fe(OH)3↓
7. Взаимодействие основных оксидов с кислотными:
CaO + SiO2 = CaSiO3
8. Взаимодействие металлов с неметаллами:
2K + Cl2 = 2KCl
9. Взаимодействие металлов с кислотами:
2Al + 6HCl = 2AlCl3 + 3H2↑
2Al + 6H+ = 2Al3+ + 3H2↑
10. Взаимодействие металлов с солями:
Fe + CuSO4 = FeSO4 + Cu
Fe + Cu2+ = Fe2+ + Cu
Свойства. Соли являются, за редким исключением, твёрдыми кристаллическими веществами. Химические свойства солей обусловливаются их отношением к металлам, щелочам, кислотам и солям.
1. В ряду стандартных электродных потенциалов каждый предыдущий металл вытесняет последующие из растворов их солей:
Zn + Hg(NO3)2 = Zn(NO3)2 + Hg
Zn + Hg2+ = Zn2+ + Hg
2. Соли взаимодействуют со щелочами:
CuSO4 + 2NaOH = Cu(OH)2 ↓+ Na2SO4
Cu2+ + 2OH- = Cu(OH)2↓
3. Соли взаимодействуют с кислотами:
CuSO4 + H2S = CuS↓ + H2SO4
Cu2+ + H2S = CuS↓+ 2H+
4. Многие соли взаимодействуют между собой:
CaCl2 + Na2CO3 = CaCO3 ↓+ 2NaCl
Ca2+ + CO32- = CaCO3↓
Реакции протекают до конца лишь в том случае, если один из образующихся продуктов уходит из сферы реакции, т.е. выпадает в виде осадка, уходит в виде газа или представляет собой малодиссоциированное соединение.
Элементы с неметаллическими свойствами занимают правый верхний угол Периодической системы. Общая электронная конфигурация их атомов – ns2np1-5, где n – номер периода; отсюда вытекает разнообразие степеней окисления неметаллов в их соединениях.
Характерным свойством неметаллов является большее (по сравнению с металлами) число электронов на внешней электронной оболочке их атомов, а следовательно, большая способность к присоединению электронов (окислительная способность), передаваемая высокими значениями их электроотрицательности.
|
|
|
В свободном виде встречаются газообразные (F2,O2, N2,Cl2) и твёрдые неметаллические простые вещества (B, C, Si, P, S, I2 и др.), при комнатной температуре известен лишь один жидкий неметалл - Br2.
Взаимодействуя с металлом, типичные неметаллы образуют соединения с ионной связью, например, NaCl, CaO, K2S. В определённых условиях неметаллы реагируют между собой, образуя соединения с ковалентной связью – как полярные, так и неполярные, например, H2O, HCl, NH3 характеризуют первый тип связей, а CO2, CH4, C6H6 – второй.
Инертные газы, кислород и азот содержатся в воздухе и их в промышленном масштабе получают сжижением и перегонкой воздуха при очень низких температурах. В земной коре в самородном состоянии встречаются также углерод и сера. Остальные неметаллы можно получить только из сложных соединений.
Если неметалл в соединении находится в отрицательной степени окисления, то получить его в виде простого вещества можно действием окислителя:
4N-3H3 + 3O2 = 2N 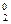 +6H2O
+6H2O
2H2S-2 + O2 = 2S0 + 2H2O
2KI-1 + 2FeCl3 = I 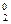 + 2KCl + 2FeCl2
+ 2KCl + 2FeCl2
16HCl-1 + 2KMnO4 = 5Cl 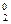 + 2KCl + 2MnCl2 + 8H2O
+ 2KCl + 2MnCl2 + 8H2O
2KBr-1 + MnO2 + 2H2SO4 = Br 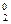 + MnSO4 + K2SO4 + 2H2O
+ MnSO4 + K2SO4 + 2H2O
Если в соединении неметалл находится в положительной степени окисления, то получить его в виде простого вещества можно действием восстановителя:
Si+4O2 + 2Mg = Si0 + 2MgO
Na2S+4O3 + 2H2S-2 + H2SO4 = 3S0↓ + Na2SO4 + 3H2O
2KCl+5O3 + I2 = Cl 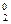 + 2KJO3
+ 2KJO3
Восстановление и окисление можно проводить, пропуская электрический ток через раствор или расплав:
а) анодное окисление:
А(+): 2H2O – 4e = O2↑ + 4H+ (раствор)
2Cl- - 2e = Cl2↑ (раствор или расплав)
2F- - 2e = F2↑ (расплав)
б) катодное восстановление:
К(-): 2H2O + 2e = H2↑ + 2OH-
Некоторые неметаллы могут быть получены за счёт термического разложения сложных веществ:
C12H22O11(сахар) = 12C + 11H2O
2KClO3 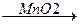 3O2↑ + 2KCl
3O2↑ + 2KCl
NH4NO2 = N2↑ + 2H2O
Поскольку неметаллы обладают высокой электроотрицательностью, их простые вещества могут выступать окислителями.
При этом восстановителями могут быть:
а) металлы
O 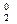 + Mg = MgO-2 (оксид магния)
+ Mg = MgO-2 (оксид магния)
N 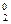 + 6Li = 2Li3N-3 (нитрид лития)
+ 6Li = 2Li3N-3 (нитрид лития)
S0 + Zn = ZnS2- (сульфид цинка)
б) менее активные неметаллы
|
|
|
O 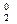 + C = CO
+ C = CO 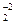
O 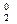 + P = P2O
+ P = P2O 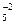
O 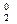 + S = SO
+ S = SO 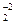
в) сложные вещества
3O 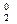 + C
+ C 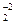 H5OH = 2C+4O
H5OH = 2C+4O 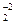 + 3H2O
+ 3H2O
Br 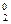 + 2Ni(OH)2 + 2KOH = 2KBr-1 + Ni2O3 + 3H2O
+ 2Ni(OH)2 + 2KOH = 2KBr-1 + Ni2O3 + 3H2O
Степень окисления, в которую при этом переходит неметалл-окислитель, легко определить по правилу n-8, где n – номер группы.
Неметаллы бывают восстановителями только в реакциях с более активными неметаллами:
3H 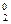 + N2 ↔ 2NH3 S0 + 3F2 = S+6F6,
+ N2 ↔ 2NH3 S0 + 3F2 = S+6F6,
а также с сильными окислителями:
6P0 + 5KClO3(при ударе) = 3P 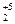 O5 + 5KCl
O5 + 5KCl
S0 +2KNO3 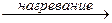 2KNO2 + S+4O2
2KNO2 + S+4O2
Углерод при высоких температурах способен восстанавливать даже некоторые оксиды металлов, например, железную руду:
3C0 + Fe2O3 = 3C+2O↑ + 2Fe
Данная реакция возможна за счёт образования газообразного продукта СО.
При взаимодействии с водой ряда наиболее активных неметаллов происходит их диспропорционирование:
Cl 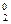 + H2O↔ HCl-1 + HOCl+1
+ H2O↔ HCl-1 + HOCl+1
3I 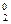 + 3H2O ↔ 5HI-1 + HI+5O3
+ 3H2O ↔ 5HI-1 + HI+5O3
Однако эти реакции идут в незначительной степени и сильно смещены влево.
Так как в реакциях образуются кислоты, то можно добиться смещение равновесия введением щёлочи:
Cl 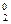 + 2NaOH = NaCl- + NaOCl+1 + H2O
+ 2NaOH = NaCl- + NaOCl+1 + H2O
При нагревании раствора галогены устойчивее в более высоких степенях окисления:
3 Cl 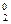 + 6KOH(раствор)
+ 6KOH(раствор)  5KCl- + 3H2O + KCl+5O3(бертолетова соль)
5KCl- + 3H2O + KCl+5O3(бертолетова соль)
По аналогичной схеме (с диспропорционированием) при нагревании в щелочах растворяются и некоторые менее активные металлы:
3S0 + 6NaOH = 2Na2S-2 + Na2S+4O3 + 3H2O
2P0 + 2NaOH + H2O = P-3H3 + Na2[P+3O3H]
Неметаллы с минимальной электроотрицательностью растворяются в щелочах с выделением водорода:
Si0 + 2 NaOH + 2H 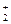 O = Na2[H2Si+4O4] + 2Н
O = Na2[H2Si+4O4] + 2Н 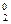 ↑
↑
Углерод реагирует с водяным паром только выше 900°С:
C0 + H 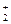 O = C+2O + H
O = C+2O + H 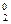 ↑
↑
Во фторе вода горит с выделением кислорода:
2F 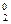 +2H2O-2 = 4HF-1 + O
+2H2O-2 = 4HF-1 + O 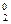
Из-за высокой прочности молекул водорода при комнатной температуре с ним реагирует только фтор (сo взрывом):
H2 + F2 = 2HF
При нагревании взрывают также смеси водорода с хлором и кислородом:
2H2 + O2 = 2H2O (гремучая смесь)
Активно идёт взаимодействие с бромом. В остальных случаях реакция идёт с трудом или вообще не идёт, поэтому соединения с водородом получают косвенным путём:
Mg2Si + 4HCl = 2MgCl2 + SiH4↑
Все соединения неметаллов с водородом состоят из молекул. Простейшие молекулы содержат один центральный атом и число атомов водорода, определяемое правилом 8-n (n – номер группы Периодической системы):
|
|
|
HCl, H2S, PH3.
Связь водорода с центральным атомом ковалентная полярная, общая электронная пара смещена к более электроотрицательному атому: H: F.
Обычно водород слабее удерживает свой электрон и приобретает положительный заряд. Часть водородных соединений при растворении в воде даёт кислоты. В подгруппе сверху вниз сила кислот увеличивается: из галогеноводородных кислот слабее всех плавиковая, сильнее всех – иодоводородная. Причина заключается в увеличении длины и снижении прочности связи Н-Э.
При взаимодействии кислотных водородных соединений со щелочами образуются соли:
H2S + 2NaOH = Na2S + 2H2O
Действием сильной или нелетучей кислоты на такую соль можно получить водородное соединение:
ZnS + 2HCl = ZnCl2 + H2S↑
KCl(сухой) + H3PO4  KH2PO4 + HCl↑
KH2PO4 + HCl↑
Из водородных соединений основную природу имеет только аммиак. В его растворе устанавливаются равновесия:
NH3 + H2O ↔ NH3∙H2O ↔ NH  + OH
+ OH 
При взаимодействии аммиака с кислотами образуются соли, содержащие ион аммония NH  :
:
NH3 + HCl(раствор) = NH4Cl
Аммиак – слабое основание, поэтому он может вытесняться из своих солей более сильными основаниями:
2NH4Cl + Ca(OH)2 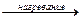 2NH3↑ + CaCl2 + 2H2O
2NH3↑ + CaCl2 + 2H2O
Соли аммония разлагаются при нагревании:
а) по обменному механизму: NH4Cl → NH3 + HCl
б) с редокс-реакцией, если анион может быть окислителем:
(N-3H4)2Cr 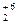 O7 → N
O7 → N 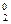 ↑ + Cr
↑ + Cr 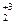 O3 + 4H2O
O3 + 4H2O
Водородные соединения ряда неметаллов в обычных условиях практически не проявляют ни кислотных, ни основных свойств (фосфин, силаны, углеводороды, бораны).
Все водородные соединения неметаллов, кроме галогеноводородов, сгорают в кислороде:
CH4 +2O2 = CO2 + 2H2O
2H2S + 3O2 = 2SO2 + 2H2O
4NH3 + 5O2 = 4NO + 6H2O
Кислород является вторым по электроотрицательности элементом, поэтому в соединениях с его участием все неметаллы, кроме фтора, проявляют положительные степени окисления.
Максимальная степень окисления неметалла равна числу электронов на валентных подуровнях, т.е. номеру группы Периодической системы. Групповую степень окисления не проявляют только F,At и инертные газы.
К кислородным соединениям неметаллов относят оксиды, отвечающие им кислоты (гидроксиды) и соли этих кислот.
Помимо высшей степени окисления n, где n – номер группы; у большинства неметаллов достаточно устойчива в кислородных соединениях степень окисления n-2:
| III | IV | V | VI | VII | VIII |
| B2O3--H3BO3 | CO2-- H2CO3 CO | N2O5-- HNO3 N2O3–HNO2 | O3 | ||
| SiO2—SiO2∙nH2O SiO | P2O5—H3PO4 P2O3—H3PO3 | SO3—H2SO4 SO2—H2SO3 | Cl2O7—HClO4 HClO3 | ||
| As2O5—H3AsO4 As2O3—HAsO2 | SeO3—H2SeO4 SeO2—H2SeO3 | HBrO4 HBrO3 | H2KrO4 | ||
| TeO3—H6TeO6 TeO2—H2TeO2 | I2O7—H5IO6 I2O5—HJO3 | XeO3—H4XeO6 XeO4—H2XeO4 |
Выделены кислоты, устойчивые только в водных растворах.
Оксиды неметаллов могут быть получены:
1) непосредственно взаимодействием неметаллов с кислородом:
S + O2 =SO2 4B + 3O2 = 2B2O3
С кислородом взаимодействуют все неметаллы, кроме благородных газов и галогенов;
2) удалением воды из кислот ( поэтому кислотные оксиды называют ангидридами кислот):
2Н3ВО3 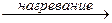 В2О3 +3Н2О
В2О3 +3Н2О
3) окислением оксидов в низших степенях окисления:
2С+2О + О2 = 2С+4О2
2S+4O2 + O2 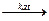 2S+6O3
2S+6O3
4) окислением других сложных веществ при нагревании:
2H2S +3O2 = 3SO2 +2H2O
CH4 + 2O2 = CO2 +2H2O
5) восстановлением оксидов в высших степенях окисления:
C+4O2 + H2 = C+2O + H2O
6) разложением солей при нагревании:
CaCO3 = CaO + CO2↑ и другими способами.
Оксиды неметаллов бывают кислотные и несолеобразующие.
Кислотные оксиды при взаимодействии с водой дают кислоты, а со щелочами – соли. Из двух кислородных кислот одного неметалла сильнее та кислота, в которой он проявляет более высокую степень окисления; например, азотная кислота HNO3 сильнее азотистой HNO2.
Кислотные свойства оксидов увеличиваются по периоду слева направо, а в подгруппе – снизу вверх; например, в рядах B2O3—CO2—N2O5,
SiO2—P2O5—SO3—Cl2O7 и Sb2O5—As2O5—P2O5—N2O5 им отвечают всё более сильные кислоты.
Кислородные кислоты неметаллов получают:
-- при взаимодействии кислотных оксидов с водой:
SO3 + H2O = H2SO4
-- вытеснением более сильными и нелетучими кислотами из солей:
KNO3(конц) + H2SO4(конц) 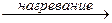 HNO3↑ + KHSO4
HNO3↑ + KHSO4
Сила и устойчивость кислоты определяется поляризующим действием катиона неметалла. Поляризующее действие заключается в деформации электронной оболочки соседних атомов или ионов. Основной фактор, влияющий нм поляризующее действие – поверхностная плотность заряда:
σe= q/S = q/(4πr2), где S – площадь поверхности, r – радиус.
В кислородных кислотах можно выделить фрагмент
Э - О – Н.
Если катион неметалла обладает высоким поляризующим действием, он оттягивает на себя электроны с кислорода, и прочность связи Н–О снижается и облегчается переход Н+ - ионов в раствор.
|
|
|
|
|
Дата добавления: 2014-11-16; Просмотров: 4840; Нарушение авторских прав?; Мы поможем в написании вашей работы!