
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Концентрация растворов
|
|
|
|
Важнейшей характеристикой раствора является относительное содержание в нем растворенного вещества и растворителя, которое называется концентрацией раствора.
Концентрация – физическая величина (размерная или безразмерная), определяющая количественны состав раствора, смеси или расплава.
Известно шесть основных способов выражения концентрации: массовая доля, молярная концентрация, молярная концентрация эквивалента, моляльность, титр и молярная доля.
1. Массовой долей растворенного вещества называется отношение его массы к массе раствора. Массовая доля обозначается символом ω. Формула (при выражении в процентах):
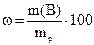
2. Молярной концентрацией растворенного вещества называется отношение его количества к объему раствора, выраженному в литрах. Символ – с (строчная русская «эс»), единица измерения – моль/л. Формула:

Часто встречается обозначение молярной концентрации символом С (прописная русская «эс») и СМ. Не рекомендуется называть этот способ термином «молярность», так как его по созвучию можно спутать с термином «моляльность». Для сокращенного обозначения единицы измерения молярной концентрации широко используется символ М: с = 1 М – одномолярный раствор, с = 0,1 М – децимолярный раствор, с = 0,2 М – двудецимолярный раствор и т.д.
3. Молярной концентрацией эквивалента растворенного вещества называется отношение количества эквивалентных масс этого вещества к объему раствора, выраженному в литрах. Символ – Сэк, единица измерении моль эк/л. Формула:
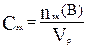
Часто встречается термин «эквивалентная концентрация». Для сокращенного обозначения единицы измерения можно использовать символ н (строчная русская «эн»): Сэк = 1 н – однонормальный раствор, Сэк = 0,1 н – децинормальный раствор и т.д.
|
|
|
4. Моляльностью растворенного вещества называется отношение его количества к массе растворителя, выраженной в килограммах. Символ Сm, единица измерения – моль/кг H2O (если растворитель – вода). Формула:

Часто встречается термин «моляльность раствора». Не рекомендуется использовать термин «моляльная концентрация», т.к. его по созвучию можно спутать с термином «молярная концентрация».
5. Титром вещества в растворе называется отношение массы растворенного вещества, выраженной в граммах, к объему раствора, выраженному в миллилитрах. Символ – Т, единица измерения – г/мл. Формула:

6. Молярной долей вещества в растворе называется отношение его количества к общему количеству веществ в растворе. Символ – χ (греческая «хи»), безразмерная величина. Формула:
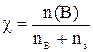
Эту концентрацию часто называют термином «мольная доля» и обозначают символом N.
Кроме рассмотренных шести способов, имеется еще один способ выражения концентрации растворов, который полезно знать изучающим химию: объемная доля.
Объемной долей растворенного вещества называется отношение объема этого вещества к объему раствора. Символ φ (греческая «фи»), выражается в процентах. Формула:
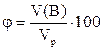
Этим способом выражают состав растворов, в которых растворенное вещество является жидким, например, водных растворов спирта, глицерина, этиленгликоля и т.д.
Плотность раствора отличается от плотности растворителя. Растворы соединений, молярная масса которых больше молярной массы воды (18 г/моль), имеют плотность больше плотности воды, причем с увеличением концентрации растворов их плотность увеличивается. Но если молярная масса растворенного вещества меньше, чем воды, то плотность раствора меньше плотности воды, и с увеличением концентрации она уменьшается. Взаимосвязь плотности и концентрации раствора выражается в виде справочных таблиц.
|
|
|
C концентрацией растворов связано много различных расчётов, которые проводятся не только в химии и химической технологии, но и в других областях техники, в которых применяются растворы.
Пример 3. В 1 л воды растворено 160 г NaOH. Выразите всеми способами концентрацию раствора, плотность которого равна 1150 кг/м³.
Решение. При решении имеем в виду, что молярная масса и молярная масса эквивалента NaOH одинаковы и равны 40 г/моль, молярная масса воды равна18 г/моль, объем 1 л – это 1000 мл, масса одного литра воды равна 1 кг (или 1000 г), а плотность 1150 кг/м³ – это 1,15 г/мл.
1) Определяем массу полученного раствора:
m = m(H2O) + m(NaOH) = 1000 + 160 = 1160 = 11,16 кг
2) Находим объем раствора: 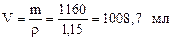
3) Вычисляем количества воды и гидроксида натрия в растворе:

4) Определяем массовую долю растворенного вещества:
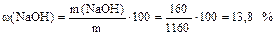
5) Находим молярную и эквивалентную концентрацию раствора:
 = 3,9655 моль/л
= 3,9655 моль/л
6) Вычисляем моляльность раствора: 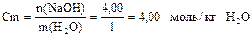
7) Определяем титр: 
8) Находим мольную долю гидроксида натрия:
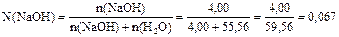
9) Находим мольную долю воды

Пример 4. Какие объемы воды и 40%-го раствора гидроксида натрия плотностью 1430 кг/м³ потребуются для приготовления 400 мл двумолярного раствора этой щелочи?
Решение. 1) Вычисляем массу NaOH, которая должна содержаться в 400 мл двумолярного раствора этой щелочи:
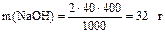
2) Находим массу 40%-го раствора, содержащего 32 г NaOH: 
3) Вычисляем объем раствора: 
4) Находим объем воды: V(H2O) = 400 – 56 = 344 мл
Пример 5. Какой объем 10%-й серной кислоты (r = 1066 кг/м³) потребуется для взаимодействия со 100 мл 13,7%-го раствора карбоната натрия Na2CO3 плотностью 1145 кг/м³?
Решение. 1) Масса 100 мл раствора Na2CO3 равна 114,5 г. Определяем массу карбоната натрия в этом растворе: m(Na2CO3) = 114,5 0,137 = 15,68 г
2) Записываем уравнение реакции и рассчитываем массу серной кислоты, взаимодействующую с 15,68 г карбоната натрия:
Na2CO3 + H2SO4 = Na2SO4 + CO2↑ + H2O
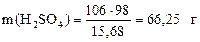
3) Вычисляем массу и объем 10%-й серной кислоты:
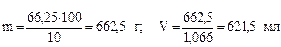
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 1662; Нарушение авторских прав?; Мы поможем в написании вашей работы!