
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворимость веществ
|
|
|
|
Растворимостью вещества называется его свойство растворяться в том или ином растворителе. Мерой этого свойства является концентрация насыщенного раствора, которая может быть выражена одним из шести рассмотренных способов. В этом случае, независимо от способа выражения, растворимость вещества обозначается символом s, например:
s(NaCl) = 26,3 % = 5,4 М = 0,316 г/мл
Часто растворимость твердых веществ выражают числом массовых единиц (г, кг), необходимых для насыщения 100 массовых единиц растворителя. Это число называется массовым коэффициентом растворимости, его символ – km, единица измерения – кг/100 кг H2O или г/100 г Н2О, которая в химических текстах обычно не указывается. Например, массовый коэффициент растворимости хлорида натрия в воде при 20 ºС равен 35,9 г/100 г Н2О; соответствующая запись должна быть такой: km(NaCl, Н2О, 20 ºС) = 35,9.
Растворимость вещества в первую очередь зависит от его состава, строения и свойств, а также от состава, строения и свойств растворителя. Она зависит также от внешних условий (от температуры и давления) и от присутствия в растворе других растворенных веществ. Общей теории растворимости нет, но некоторые закономерности на качественном уровне объяснимы.
Еще в период алхимии было установлено правило: подобное растворяется в подобном, т.е. ионные и полярные соединения растворимы в полярных растворителях, например, соли в воде, а неполярные соединения – в неполярных растворителях, например, бензол в ацетоне.
Растворимость вещества увеличивается при образовании между ним и растворителем водородной связи (спирт, сахар, фтороводород, серная кислота, фосфорная кислота, аммиак в воде).
При значении коэффициента растворимости km более 1 г/100 г Н2О вещество называется растворимым (Р), менее 0,01 г/100 г Н2О – нерастворимым (Н), от 0,01 до 1 г/100 Н2О – малорастворимым (М). Вещества с неограниченной растворимостью обозначаются символом ∞.
|
|
|
Пример 6. При растворении 360 г хлорида натрия в одном литре воды при 20 °С образовался насыщенный раствор плотностью 1,2 кг/л. Вычислите коэффициент растворимости хлорида натрия, его массовую долю в насыщенном растворе и молярную концентрацию насыщенного раствора.
Решение. 1) Масса одного литра воды равна 1 кг (или 1000 г). Если в одном литре воды растворяется 360 г вещества, то в 100 г – 36,0 г. Следовательно, коэффициент растворимости NaCl в воде при температуре 20 ºС равен 36,0.
2) Масса насыщенного раствора равна 1360 г, масса соли в нем 360 г, поэтому массовая доля хлорида натрия в насыщенном растворе равна:
 = 26,5 %
= 26,5 %
3) Объем получаемого насыщенного раствора составляет 1,36: 1,2 = 1,13 л. Молярная масса NaCl равна 58,5 г/моль, следовательно, количество хлорида натрия в растворе равно 360: 58,5 = 6,15 моль. Вычисляем молярную концентрацию раствора:

Пример 7. Коэффициент растворимости нитрата калия при 60 ˚С равен 110. Какая масса этого вещества растворяется при данной температуре в 500 мл воды и чему равна масса получаемого насыщенного раствора?
Решение. Масса 500 мл воды составляет 500 г. Коэффициент растворимости (110) показывает массу вещества, которая растворяется в 100 г воды, следовательно, в 500 г воды растворяется 550 г KNO3. Масса полученного насыщенного раствора будет равна 1050 г (или 1,05 кг).
Растворимость газов выражают в мл газа (объем газа приведен к нормальным условиям), растворяющихся в 100 г воды. Эта величина называется объемным коэффициентом растворимости газа, символ – kv, единица измерения –мл/100 г Н2О.
Пример 8. Растворимость хлора в воде при 20 ˚С равна 300 мл газа в 100 г воды. Чему равна массовая доля Cl2 в насыщенной при этой температуре хлорной воде?
|
|
|
Решение. 1) При любой температуре растворимость газа выражается объемом, приведенным к нормальным условиям. Поэтому вначале вычисляем массу хлора в растворе, имея в виду, что молярная масса хлора равна 71 г/моль:

2) Масса раствора составляет 100 + 0,95 = 100,95 г, следовательно, массовая доля хлороводорода в нем равна:

Растворимость газов выражают также безразмерным числом, которое показывает, сколько объемов газа растворяется в одном объеме растворителя при нормальном давлении. Это число называется коэффициентом абсорбции газа; символ – а. Так, коэффициент абсорбции хлороводорода водой при 0 ºС равен 505; это означает, что в литре воды растворяется 505 л HCl, что позволяет рассчитать массовую долю хлороводорода в насыщенном растворе при 0 ºС (45 %).
Пример 9. Коэффициент абсорбциисероводорода в воде при 20 ˚С равен 2,6. Чему равна массовая доля Н2S в насыщенном растворе сероводородной воды (сероводородной кислоты) при 20 ˚С, и молярная концентрация раствора, плотность которого близка 1?
Решение. 1) Объем газа, который указывается коэффициентом абсорбции, приведен к нормальным условиям, поэтому вначале вычисляем массу растворенного сероводорода (М = 34 г/моль):
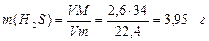
2) Масса одного литра воды равна 1000 г, масса раствора равна 1000 + 3,95 = 1003,95 г; находим массовую долю H2S в растворе:

3) Если плотность раствора близка единице, то объем раствора равен одному литру; исходя из этого, вычисляем молярную концентрацию раствора:

На растворимость веществ влияет температура. Растворимость твердых веществ, растворяющихся с поглощением тепла, при повышении температуры увеличивается, а для тех веществ, которые растворяются с выделением тепла, – уменьшается. Растворимость газообразных веществ уменьшается при повышении температуры (при кипячении воды из неё улетучиваются все растворённые газы) и увеличивается при повышении давления.
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 1139; Нарушение авторских прав?; Мы поможем в написании вашей работы!