
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закономерности протекания химических реакций
|
|
|
|
Задачи
6.1. Указать тип химической связи в молекулах  ,
,  ,
, 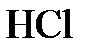 . Привести схему перекрывания электронных облаков.
. Привести схему перекрывания электронных облаков.
6.2. Как изменяется прочность связи в ряду:  ? Указать причины этих изменений.
? Указать причины этих изменений.
6.3. Описать с позиций метода валентных связей электронное строение молекулы  и иона
и иона  .
.
6.4. Сравнить способы образования ковалентных связей в молекулах  ,
, 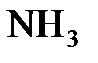 и в ионе
и в ионе  . Могут ли существовать ионы
. Могут ли существовать ионы  и
и  ?
?
6.5. Какой том или ион служит донором электронной пары при образовании иона 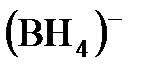 ?
?
6.6. Объяснить с позиций метода валентных связей возможность образования молекулы  .
.
6.7. Описать электронное строение молекул  и
и  с позиций метода валентных связей. Какая из молекул характеризуется большей кратностью связи?
с позиций метода валентных связей. Какая из молекул характеризуется большей кратностью связи?
6.8. Почему не могут существовать устойчивые молекулы  и
и  ?
?
6.9. Чему равна ковалентность углерода в молекуле  ?
?
6.10. Какова кратность связи в молекуле  ?
?
6.11. Температура плавления  - 780°С,
- 780°С,  - 560°С; радиус иона
- 560°С; радиус иона 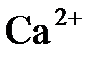 равен 0,104 нм, иона
равен 0,104 нм, иона  - 0,099 нм. Объяснить различие температур плавления.
- 0,099 нм. Объяснить различие температур плавления.
6.12. При переходе от  к
к  температура плавления кристаллов уменьшается. Объяснить наблюдаемый ход изменения температур плавления.
температура плавления кристаллов уменьшается. Объяснить наблюдаемый ход изменения температур плавления.
6.13.  плавится при 890°С без разложения,
плавится при 890°С без разложения,  разлагается уже при 220°С. Объяснить указанное различие.
разлагается уже при 220°С. Объяснить указанное различие.
6.14. У какого из соединений -  или
или  - температура плавления выше?
- температура плавления выше?
6.15. Почему благородные газы в отличие от других газообразных веществ (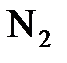 ,
,  ,
,  ,
, 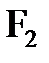 ,
, 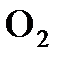 ) существуют при обычных условиях в виде атомов, а не молекул?
) существуют при обычных условиях в виде атомов, а не молекул?
6.16. Энергия связи молекул  ,
, 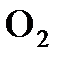 и
и  соответственно равны 430, 495 и 240 кДж/моль. Расположить их в ряд в порядке возрастания прочности.
соответственно равны 430, 495 и 240 кДж/моль. Расположить их в ряд в порядке возрастания прочности.
6.17. Почему молекулы водорода имеют состав  , а не
, а не  ,
,  и т.д.; молекулы метана -
и т.д.; молекулы метана -  , а не
, а не  ,
,  и т.д.; молекулы хлороводорода -
и т.д.; молекулы хлороводорода -  , а не
, а не  ,
,  и т.д.?
и т.д.?
6.18. Какая из связей наиболее полярна:  ,
,  ,
,  ? К какому из атомов смещается электронное облако?
? К какому из атомов смещается электронное облако?
|
|
|
6.19. Изобразить электронными уравнениями процессы образования из атомов следующих соединений с ионной связью:  ,
,  ,
,  ,
,  .
.
6.20. Какие орбитали участвуют в образовании молекул  ,
,  ,
, 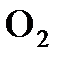 и
и 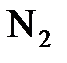 ? Сколько электронных пар участвует в образовании связей между атомами в названных молекулах?
? Сколько электронных пар участвует в образовании связей между атомами в названных молекулах?
Химические реакции подразделяются на гомогенные и гетерогенные. Первые протекают в системах, не имеющих границы раздела фаз (газы, жидкости), а вторые - в системах, обладающих такой границей, на которой свойства системы меняются скачкообразно. Одной из важнейших характеристик химической реакции является ее скорость. Скоростью химической реакции называется количество вещества, вступающего в реакцию или образующегося в ее ходе за единицу времени в единице объема системы (для гомогенной реакции) или на единице площади раздела фаз (для гетерогенных реакций). Количественно скорость реакции можно выразить как отношение изменения концентрации реагентов или продуктов реакции 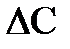 к интервалу времени
к интервалу времени  , за который произошли эти изменения:
, за который произошли эти изменения:  . Скорость реакции является функцией природы реагентов, их концентрации, температуры. Зависимость скорости гетерогенной реакции
. Скорость реакции является функцией природы реагентов, их концентрации, температуры. Зависимость скорости гетерогенной реакции  от концентраций реагентов
от концентраций реагентов  и
и  определяется законом действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагентов. Математически закон действия масс выражается соотношением:
определяется законом действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагентов. Математически закон действия масс выражается соотношением:  , где
, где  - константа скорости реакции. Для реакции
- константа скорости реакции. Для реакции  её скорость
её скорость  .
.
При изменении температуры меняется как скорость реакции, так и её константа, но таким образом, что отношение скорости реакции при температуре ( )°С к скорости при температуре
)°С к скорости при температуре 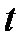 °С равно отношению констант скорости реакции при тех же температурах:
°С равно отношению констант скорости реакции при тех же температурах:  , где
, где  - температурный коэффициент скорости реакции, значение которого для большинства реакций находится в пределах от 2 до 4 (правило Вант-Гоффа). Если температура изменяется не на 10, а на
- температурный коэффициент скорости реакции, значение которого для большинства реакций находится в пределах от 2 до 4 (правило Вант-Гоффа). Если температура изменяется не на 10, а на  °С, то правило приобретает несколько другой вид:
°С, то правило приобретает несколько другой вид:  .
.
|
|
|
В ходе реакции концентрации реагентов постепенно уменьшаются. Тогда, в соответствии с законом действия масс, уменьшается и скорость реакции. Иногда взаимодействие продуктов реакции приводит к образованию исходных веществ, вступивших в реакцию. В этих случаях говорят об обратимых реакциях. По мере исчерпания исходных веществ увеличивается концентрация продуктов реакции, значит, возрастает и скорость обратной реакции. Наконец наступает такой момент, когда скорости прямой и обратной реакций уравниваются, возникает состояние химического равновесия, при котором концентрации исходных веществ и продуктов реакции остаются неизменными. Если обратимая реакция (обозначим ее вместо знака равенства знаком  ) описывается выражением
) описывается выражением 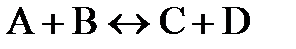 , то скорость прямой реакции
, то скорость прямой реакции  , а скорость обратной реакции
, а скорость обратной реакции  . В состоянии химического равновесия
. В состоянии химического равновесия  , откуда следует, что отношение
, откуда следует, что отношение  , равное отношению
, равное отношению  , есть величина постоянная, она обозначается буквой
, есть величина постоянная, она обозначается буквой  иназывается константой химического равновесия реакции. Для общего случая обратимой реакции, описываемой уравнением
иназывается константой химического равновесия реакции. Для общего случая обратимой реакции, описываемой уравнением  , константа равновесия реакции
, константа равновесия реакции  .
.
Рассмотрим примеры решения типовых задач по данному разделу.
Пример 1. Как изменится скорость реакции  , если концентрация реагентов увеличится в 3 раза?
, если концентрация реагентов увеличится в 3 раза?
Решение. Запишем выражение для скорости реакции до и после изменения концентраций реагентов -  и
и 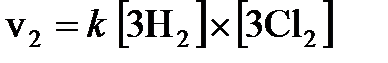 - и найдем отношение
- и найдем отношение  .
.
Ответ: Скорость реакции возрастет в 9 раз.
Пример 2. При увеличении температуры на 50°С скорость реакции возросла в 1024 раза. Найти температурный коэффициент реакции.
Решение. В соответствии с правилом Вант-Гоффа, 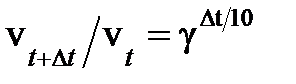 . По условию задачи, отношение скоростей равно 1024, т.е.
. По условию задачи, отношение скоростей равно 1024, т.е.  1024. Прологарифмировав это соотношение, получаем:
1024. Прологарифмировав это соотношение, получаем: 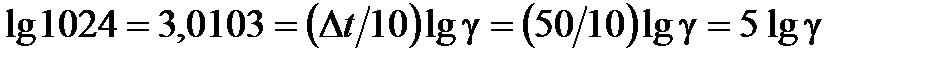 . Значит,
. Значит,  , откуда потенцированием находим величину
, откуда потенцированием находим величину  4.
4.
Ответ: Температурный коэффициент реакции  4.
4.
Пример 3. В состоянии равновесия обратимой реакции  концентрации веществ равны:
концентрации веществ равны:  1,5 моль/л;
1,5 моль/л;  4,5 моль/л;
4,5 моль/л;  2 моль/л. Чему равны исходные концентрации водорода и азота и константа химического равновесия?
2 моль/л. Чему равны исходные концентрации водорода и азота и константа химического равновесия?
Решение. Исходя из уравнения реакции, константа химического равновесия,
|
|
|
 .
.
Далее, из уравнения реакции следует, что 1 моль азота реагирует с 3 молями водорода. Это значит, что изменение концентрации водорода и изменение концентрации азота связаны соотношением:  . С другой стороны, из уравнения реакции следует, что
. С другой стороны, из уравнения реакции следует, что  2 моль/л (по условию задачи). Откуда получаем:
2 моль/л (по условию задачи). Откуда получаем: 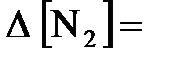 1 моль/л, а
1 моль/л, а  3 моль/л. Выразим теперь исходные концентрации азота и водорода через равновесные и через изменения концентраций:
3 моль/л. Выразим теперь исходные концентрации азота и водорода через равновесные и через изменения концентраций:  4,5 моль/л;
4,5 моль/л;  1,5 моль/л.
1,5 моль/л.
Окончательно получаем:  4,5 моль/л + 3 моль/л = 7,5 моль/л;
4,5 моль/л + 3 моль/л = 7,5 моль/л; 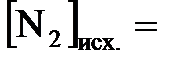 1,5 моль/л +
1,5 моль/л +  1,5 моль/л + 1 моль/л = 2,5 моль/л.
1,5 моль/л + 1 моль/л = 2,5 моль/л.
Ответ:  7,5 моль/л;
7,5 моль/л;  2,5 моль/л;
2,5 моль/л; 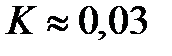 .
.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 726; Нарушение авторских прав?; Мы поможем в написании вашей работы!