
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворы электролитов
|
|
|
|
Задачи
8.1. Сколько граммов 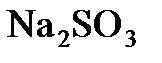 потребуется для приготовления 5 л 8%-ного (по массе) раствора (
потребуется для приготовления 5 л 8%-ного (по массе) раствора (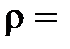 1,075 г/мл)?
1,075 г/мл)?
8.2. 1 мл 25%-ного (по массе) раствора содержит 0,458 г растворенного вещества. Какова плотность этого раствора?
8.3. Из 400 г 50%-ного (по массе) раствора 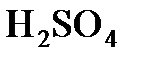 выпариванием удалили 100 г воды. Чему равна массовая доля
выпариванием удалили 100 г воды. Чему равна массовая доля 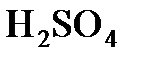 в оставшемся растворе?
в оставшемся растворе?
8.4. Определить массовую долю вещества в растворе, полученном смещением 300 г 25%-ного и 400 г 40%-ного (по массе) растворов этого вещества.
8.5. Определить массовую долю 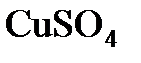 в растворе, полученном при растворении 50 г медного купороса
в растворе, полученном при растворении 50 г медного купороса 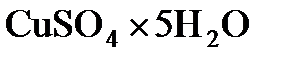 в 450 г воды.
в 450 г воды.
8.6. Сколько граммов 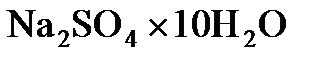 надо растворить в 800 г воды, чтобы получить 10%-ный (по массе) раствор
надо растворить в 800 г воды, чтобы получить 10%-ный (по массе) раствор 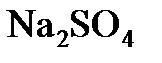 ?
?
8.7. Найти массу  , необходимую для приготовления 300 мл 0,2М раствора.
, необходимую для приготовления 300 мл 0,2М раствора.
8.8. Сколько граммов 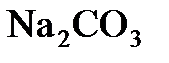 содержится в 500 мл 0,25 н. раствора?
содержится в 500 мл 0,25 н. раствора?
8.9. В каком объеме 0,1 н. раствора содержится 8 г 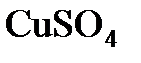 ?
?
8.10. Плотность 40%-ного (по массе) раствора  равна 1,25 г/мл. Рассчитать молярность и моляльность этого раствора.
равна 1,25 г/мл. Рассчитать молярность и моляльность этого раствора.
8.11. В 1 кг воды растворено 666 г  ; плотность раствора равна 1,395 г/мл. Найти: а) массовую долю
; плотность раствора равна 1,395 г/мл. Найти: а) массовую долю  ; б) молярность; в) моляльность; г) мольные доли щелочи и воды.
; б) молярность; в) моляльность; г) мольные доли щелочи и воды.
8.12. Плотность 15%-ного (по массе) раствора 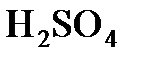 равна 1,105 г/мл. Вычислить: а) нормальность; б) молярность; в) моляльность раствора.
равна 1,105 г/мл. Вычислить: а) нормальность; б) молярность; в) моляльность раствора.
8.13. Имеется раствор, в 1 л которого содержится 18,9 г  , и раствор, содержащий в 1л 3,2 г
, и раствор, содержащий в 1л 3,2 г 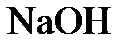 . В каком объемном отношении нужно смешать эти растворы для получения раствора, имеющего нейтральную реакцию?
. В каком объемном отношении нужно смешать эти растворы для получения раствора, имеющего нейтральную реакцию?
8.14. Какой объем 0,2 н. раствора щелочи потребуется для осаждения в виде 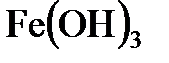 всего железа, содержащегося в 100 мл 0,5 н. раствора
всего железа, содержащегося в 100 мл 0,5 н. раствора 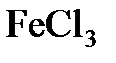 ?
?
8.15. Для нейтрализации 20 мл 0,1 н. раствора кислоты потребовалось 8 мл раствора 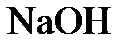 . Сколько граммов
. Сколько граммов 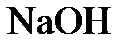 содержит 1 л этого раствора?
содержит 1 л этого раствора?
8.16. На нейтрализацию 40 мл раствора щелочи израсходовано 25 мл 0,5 н. раствора 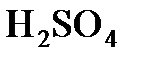 . Какова нормальность раствора щелочи? Какой объем 0,5 н. раствора
. Какова нормальность раствора щелочи? Какой объем 0,5 н. раствора 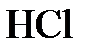 потребовался бы для этой же цели?
потребовался бы для этой же цели?
|
|
|
8.17. Для полного осаждения 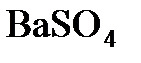 из 100 г 15%-ного (по массе) раствора
из 100 г 15%-ного (по массе) раствора 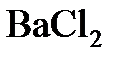 потребовалось 14,4 мл
потребовалось 14,4 мл 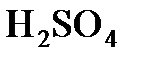 . Найти нормальность раствора
. Найти нормальность раствора 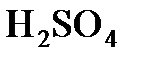 .
.
8.18. 300 г раствора 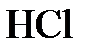 нейтрализованы раствором гидроксида натрия. Раствор образовавшегося хлорида натрия выпарен, масса сухой соли оказалась равной 117 г. Определить массовую долю (в %)
нейтрализованы раствором гидроксида натрия. Раствор образовавшегося хлорида натрия выпарен, масса сухой соли оказалась равной 117 г. Определить массовую долю (в %) 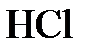 в растворе.
в растворе.
8.19. Определить молярную и эквивалентную концентрацию 40%-ного раствора азотной кислоты ( 1250 кг/м3).
1250 кг/м3).
8.20. Определить эквивалентную концентрацию раствора азотной кислоты, если 500 мл его полностью нейтрализуют раствор, содержащий 4 г  ?
?
Твердые вещества, с точки зрения проводимости электрического тока их водными растворами, делятся на электролиты и неэлектролиты; растворы электролитов проводят электрический ток, а растворы неэлектролитов - нет. К электролитам относятся химические соединения с ионной или с сильнополярной ковалентной связью - кислоты, щелочи, соли. Важно отметить, что в твердом состоянии электролиты электрического тока не проводят, плохо проводит электрический ток и вода. Поэтому тот факт, что водные растворы электролитов электропроводны, означает, что при образовании растворов с электролитами происходят какие-то изменения, обусловливающие возникновение электрической проводимости. Эти изменения сводятся к тому, что при растворении в воде электролиты распадаются (диссоциируют) на ионы: положительно заряженные катионы и отрицательно заряженные анионы. В растворе электролита ионы движутся хаотически, а при пропускании постоянного электрического тока через раствор катионы движутся к катоду, а анионы - к аноду.
Электролиты в растворах обычно не полностью диссоциируют на ионы, часть их существует в растворе в молекулярной форме. Отношение числа молекул электролита, распавшихся в данном растворе на ионы, к общему числу его молекул в растворе называется степенью электролитической диссоциации. Математически это выражается соотношением: 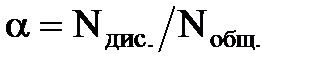 . Если
. Если 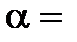 0, это означает, что вещество в растворе не диссоциирует на ионы. Если же для какого-то вещества
0, это означает, что вещество в растворе не диссоциирует на ионы. Если же для какого-то вещества  1 (или 100%), то в растворе все его молекулы диссоциируют на ионы. В зависимости от величины
1 (или 100%), то в растворе все его молекулы диссоциируют на ионы. В зависимости от величины  электролиты делятся на сильные (
электролиты делятся на сильные (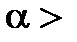 0,3), средние (0,03
0,3), средние (0,03 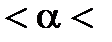 0,3) и слабые (0
0,3) и слабые (0 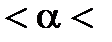 0,03). Отличие
0,03). Отличие 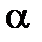 от 1 отчасти объясняется тем, что процесс электролитической диссоциации обратим, в особенности это справедливо для слабых электролитов:
от 1 отчасти объясняется тем, что процесс электролитической диссоциации обратим, в особенности это справедливо для слабых электролитов:
|
|
|
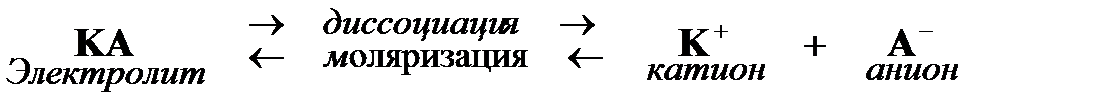 .
.
Равновесие, которое устанавливается в растворе слабого электролита, характеризуют константой диссоциации. Например, для диссоциации соляной кислоты 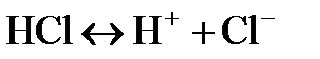 константа диссоциации
константа диссоциации 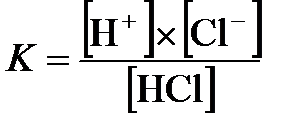 .
.
Величина 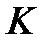 характеризует способность данного электролита диссоциировать на ионы: чем больше
характеризует способность данного электролита диссоциировать на ионы: чем больше 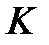 ,тем легче электролит распадается в растворе на ионы.
,тем легче электролит распадается в растворе на ионы.
Константа и степень диссоциации связаны друг с другом следующим соотношением (закон разбавления Оствальда):
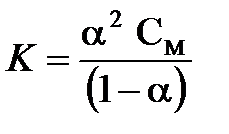 ,
,
где 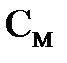 - молярная концентрация электролита в растворе.
- молярная концентрация электролита в растворе.
Если  , выражение в знаменателе дроби приблизительно равно 1, тогда выражение закона разбавления Оствальда приобретает более простой вид:
, выражение в знаменателе дроби приблизительно равно 1, тогда выражение закона разбавления Оствальда приобретает более простой вид:
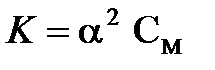 .
.
Последнее соотношение позволяет сделать вывод, что при разбавлении раствора водой (т.е. уменьшении 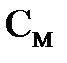 ) степень диссоциации электролита увеличивается.
) степень диссоциации электролита увеличивается.
Многоосновные кислоты и многокислотные основания диссоциируют ступенчато с отщеплением по одному иону 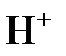 или по одной
или по одной 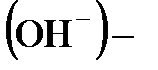 группе, соответственно, в каждой ступени диссоциации.
группе, соответственно, в каждой ступени диссоциации.
Вода относится к очень слабым электролитам. Она диссоциирует на ионы водорода и гидроксид-ионы: 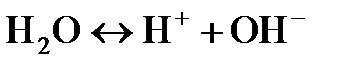 .
.
Константа диссоциации воды:
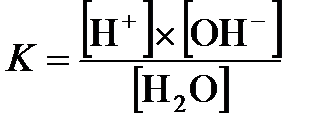 .
.
Поскольку 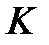 очень мало, то концентрацию недиссоциированной воды в знаменателе этого выражения можно считать равной ее общей концентрации, и тогда произведение
очень мало, то концентрацию недиссоциированной воды в знаменателе этого выражения можно считать равной ее общей концентрации, и тогда произведение 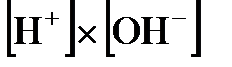 тоже будет постоянной величиной, которая получила название ионного произведения воды. В чистой воде при комнатной температуре концентрации ионов водорода и гидроксид-ионов одинаковы и равны
тоже будет постоянной величиной, которая получила название ионного произведения воды. В чистой воде при комнатной температуре концентрации ионов водорода и гидроксид-ионов одинаковы и равны 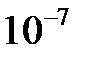 моль/л. Это значит, что
моль/л. Это значит, что 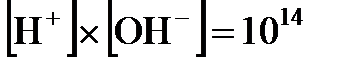 . Вместо концентраций ионов водорода и гидроксид-ионов на практике чаще пользуются так называемыми водородным и гидроксильным показателями:
. Вместо концентраций ионов водорода и гидроксид-ионов на практике чаще пользуются так называемыми водородным и гидроксильным показателями:
|
|
|
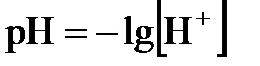 ;
; 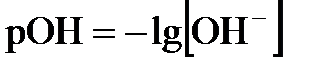 .
.
Прологарифмировав выражение 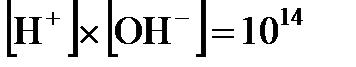 , получаем, что при 25°С
, получаем, что при 25°С 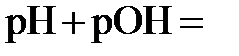 14.
14.
В нейтральных растворах 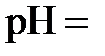 7, в кислых -
7, в кислых - 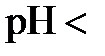 7, в щелочных -
7, в щелочных - 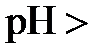 7.
7.
А теперь рассмотрим примеры решения типовых задач.
Пример 1. Степень диссоциации муравьиной кислоты 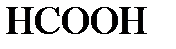 в 0,2 н. растворе равна 0,03. Определить константу диссоциации кислоты.
в 0,2 н. растворе равна 0,03. Определить константу диссоциации кислоты.
Решение. Воспользуемся выражением закона разбавления Оствальда:
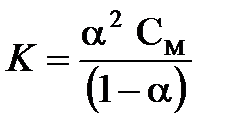 .
.
В это выражение вместо 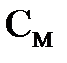 можно поставить нормальную концентрацию, поскольку муравьиная кислота относится к одноосновным кислотам. Следовательно,
можно поставить нормальную концентрацию, поскольку муравьиная кислота относится к одноосновным кислотам. Следовательно, 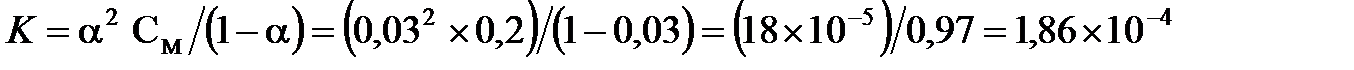 .
.
Ответ: 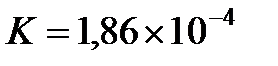 .
.
Пример 2. Вычислить значения 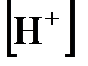 ,
, 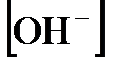 и
и 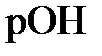 для раствора муравьиной кислоты из предыдущего примера.
для раствора муравьиной кислоты из предыдущего примера.
Решение. По закону разбавления Оствальда мы нашли величину 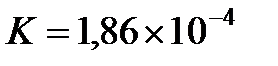 , которая, с другой стороны, равна
, которая, с другой стороны, равна 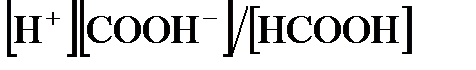 . По условию задачи,
. По условию задачи, 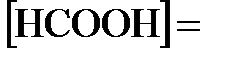 0,2 моль/л. Поэтому можно записать, что
0,2 моль/л. Поэтому можно записать, что 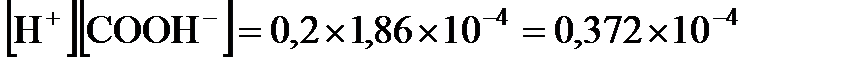 .
.
Далее, поскольку концентрация ионов водорода  при диссоциации молекул кислоты равна концентрации кислотного остатка
при диссоциации молекул кислоты равна концентрации кислотного остатка  , то
, то 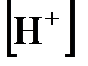 будет равна корню квадратному из
будет равна корню квадратному из 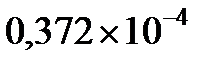 , т.е.
, т.е. 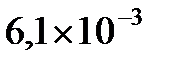 . Отсюда находим
. Отсюда находим 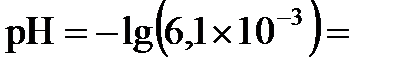 2,21. Поскольку
2,21. Поскольку 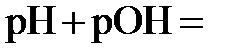 14, то, зная
14, то, зная 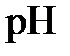 , получаем
, получаем 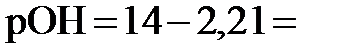 11,79. Наконец, из соотношения
11,79. Наконец, из соотношения  11,79 рассчитываем
11,79 рассчитываем 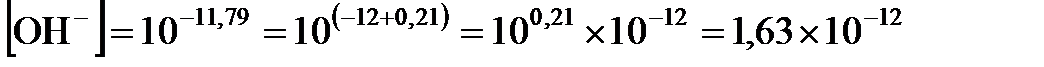 (моль/л).
(моль/л).
Ответ: 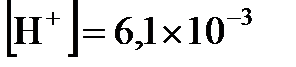 моль/л;
моль/л; 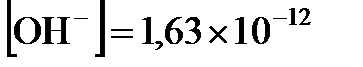 моль/л;
моль/л; 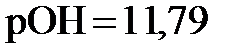 .
.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 794; Нарушение авторских прав?; Мы поможем в написании вашей работы!