
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окислительно-восстановительные реакции. 9.1. Константа диссоциации масляной кислоты равна
|
|
|
|
Задачи
9.1. Константа диссоциации масляной кислоты  равна
равна  . Вычислить степень ее диссоциации в 0,005 М растворе.
. Вычислить степень ее диссоциации в 0,005 М растворе.
9.2. Степень диссоциации угольной кислоты 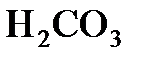 по первой ступени в 0,1 н. растворе равна
по первой ступени в 0,1 н. растворе равна  . Вычислить
. Вычислить  .
.
9.3. При какой концентрации раствора степень диссоциации азотистой кислоты  будет равна 0,2?
будет равна 0,2?
9.4. В 0,1 н. растворе степень диссоциации уксусной кислоты равна  . При какой концентрации азотистой кислоты
. При какой концентрации азотистой кислоты  ее степень диссоциации будет такой же?
ее степень диссоциации будет такой же?
9.5. Сколько воды нужно прибавить к 300 мл 0,2 М раствора уксусной кислоты, чтобы степень диссоциации кислоты удвоилась?
9.6. Чему равна концентрация ионов водорода  в водном растворе муравьиной кислоты, если
в водном растворе муравьиной кислоты, если  0,03?
0,03?
9.7. Какие ионы содержатся в растворах: 1) едкого натра; 2) бромоводорода; 3) азотной кислоты; 4) сульфата меди?
9.8. Какие ионы образуются при диссоциации следующих кислот: 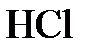 ,
,  ,
,  ,
,  ?
?
9.9. Написать уравнение последовательной ступенчатой диссоциации серной кислоты  , сернистой кислоты
, сернистой кислоты  , фосфорной кислоты
, фосфорной кислоты  , сероводородной кислоты
, сероводородной кислоты  .
.
9.10. На какие ионы распадается при диссоциации каждое из перечисленных ниже веществ: сульфат калия, сульфат алюминия, фторид натрия, бромид кальция?
9.11. Найти молярную концентрацию ионов  в водных растворах, в которых концентрация гидроксид-ионов (в моль/л) составляет: а)
в водных растворах, в которых концентрация гидроксид-ионов (в моль/л) составляет: а) 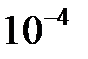 ; б)
; б)  ; в)
; в) 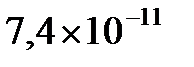 .
.
9.12. Найти молярную концентрацию ионов  в водных растворах, в которых концентрация ионов водорода (в моль/л) равна: а)
в водных растворах, в которых концентрация ионов водорода (в моль/л) равна: а)  ; б)
; б)  ; в)
; в)  .
.
9.13. Вычислить  растворов, в которых концентрация ионов
растворов, в которых концентрация ионов  (в моль/л) равна: а)
(в моль/л) равна: а)  ; б)
; б)  ; в)
; в)  .
.
9.14. Вычислить  растворов, в которых концентрация ионов
растворов, в которых концентрация ионов  (в моль/л) равна: а)
(в моль/л) равна: а)  ; б)
; б)  ; в)
; в)  .
.
9.15. Определить [  ] и [
] и [  ] в растворе,
] в растворе,  которого равен 6,2.
которого равен 6,2.
9.16. Определить концентрацию ионов водорода в растворе,  которого равен 3.
которого равен 3.
|
|
|
9.17. Определить концентрацию гидроксид-ионов в растворе,  которого равен 11.
которого равен 11.
9.18. Концентрация ионов водорода в растворе равна 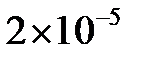 моль/л. Определить
моль/л. Определить  раствора.
раствора.
9.19. Концентрация гидроксид-ионов в растворе составляет  моль/л. Определить концентрацию ионов
моль/л. Определить концентрацию ионов  и
и  раствора.
раствора.
9.20. Концентрация ионов водорода в растворе равна  моль/л. Определить концентрацию ионов
моль/л. Определить концентрацию ионов  в растворе.
в растворе.
Для многих сложных веществ химические связи между атомами различных элементов несимметричны. Наиболее сильно неравномерность распределения электронов выражена в ионных соединениях, у которых валентные электроны почти полностью переходят от атома одного элемента к атому другого. Неравномерность распределения электронов между атомами в сложных соединениях называется окисленностью. Различают положительную и отрицательную окисленность. Первое понятие относится к элементам, электроны от которых смещаются к атомам других элементов; второе - характеризует элементы, к атомам которых смещаются электроны от первых. Число смещенных электронов называется степенью окисления (окисленности).
Степень окисления элементов в простых веществах равна нулю, а в соединениях она может быть либо неизменной, либо различной в зависимости от типа соединения. Постоянную степень окисленности демонстрируют фтор (-1), щелочные (+1) и щелочно-земельные (+2) металлы. Степень окисления водорода в большинстве случаев равна +1, а в гидридах металлов ( ) она принимает значение -1. Степень окисленности кислорода в большинстве соединений равна -2, в перекисных соединениях она равна -1, а во фториде кислорода (
) она принимает значение -1. Степень окисленности кислорода в большинстве соединений равна -2, в перекисных соединениях она равна -1, а во фториде кислорода ( ) - +2.
) - +2.
В любом соединении сумма степеней окисления всех атомов равна нулю. Пользуясь этим правилом и стандартными степенями окисленности водорода (+1) и кислорода (-2), можно определить степень окисления любого элемента. Степени окисления элементов, входящих в состав реагентов, могут либо изменяться в ходе реакции, либо оставаться неизменными. Например, в реакции
|
|
|
 -
-
степень окисления цинка изменилась от 0 до +2, а водорода - от +1 до 0.
В реакции другого типа:
 -
-
степени окисления всех элементов остались прежними. Реакции, протекающие с изменением степеней окисления атомов входящих в состав реагирующих веществ, называются окислительно-восстановительными реакциями. Процесс отдачи электронов атомом (молекулой, ионом), сопровождающийся повышением степени окисления, называется окислением. В отличие от этого, процесс присоединения электронов атомом (молекулой, ионом), сопровождающийся понижением степени окисления, называется восстановлением. Вещество, в состав которого входит окисляющийся элемент (или сам этот элемент) называется восстановителем, а вещество, содержащее восстанавливающийся элемент (или сам этот элемент), - окислителем. Так, в реакции образования хлорида натрия натрий способствует восстановлению хлора, значит, он - восстановитель. В то же время хлор, способствуя окислению натрия, является окислителем. Число электронов, отдаваемых атомами (молекулами, ионами) восстановителя, равно числу электронов, присоединяемых атомами (молекулами, ионами) окислителя, что обеспечивает электронейтральность любого продукта окислительно-восстановительной реакции.
Среди окислительно-восстановительных реакций различают реакции трех типов. Во-первых, это реакции внутримолекулярного окисления-восстановления, которые идут с изменением степени окисления сразу нескольких атомов одной молекулы ( ):
):

Внизу под символами азота и кислорода указаны их степени окисления как в исходном нитрате натрия, так и в продуктах его разложения. Во-вторых, это реакции межмолекулярного окисления-восстановления, которые протекают с изменением степени окисления атомов в молекулах разных веществ:
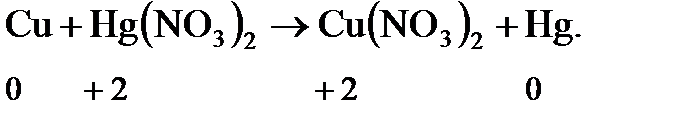
Как следует из уравнения этой реакции, медь и ртуть действительно либо являются простыми веществами, либо входят в состав разных молекул. Наконец, в-третьих, это реакции самоокисления-самовосстановления (диспропорционирования):
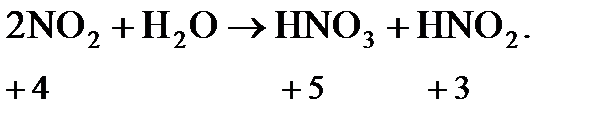
В таких реакциях атомы одного и того же элемента взаимодействуют друг с другом так, что одни из них окисляются, а другие - восстанавливаются (смотри уравнение реакции с указанными степенями окисления азота).
|
|
|
Рассмотрим решение задачи на определение степени окисленности элемента.
Пример. Определить степень окисленности углерода в соединениях 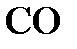 ,
,  ,
,  ,
,  ,
,  .
.
Решение. Обозначим степень окисления углерода в каждом соединении через х и учтем, что, во-первых, все соединения электронейтральны, и, во-вторых, то, что водород и кислород в данных соединениях демонстрируют их стандартные степени окисления.
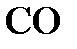 : х + (-2) = 0, откуда х = +2;
: х + (-2) = 0, откуда х = +2;
 : х + 2(-2) = 0, откуда х = +4;
: х + 2(-2) = 0, откуда х = +4;
 : х + 4(+1) = 0, откуда х = -4;
: х + 4(+1) = 0, откуда х = -4;
 : 2 х + 6(+1) = 0, откуда х = -3;
: 2 х + 6(+1) = 0, откуда х = -3;
 : 2 х + 5(+1) + (-2) + (+1)= 0, откуда х = -2.
: 2 х + 5(+1) + (-2) + (+1)= 0, откуда х = -2.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 720; Нарушение авторских прав?; Мы поможем в написании вашей работы!