
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Навчальний посібник. технічних напрямів підготовки
|
|
|
|
Х І М І Я
Навчальний посібник
Х І М І Я
для студентів
технічних напрямів підготовки
Рекомендовано Методичною радою НТУУ «КПІ»
Київ НТУУ «КПІ» 2011
Хімія. Навчальний посібник длястудентів технічних напрямів підготовки / Уклад.: О. М. Князєва, В. А. Потаскалов. – К.: 2011. – 160 с.
Гриф надано Методичною радою НТУУ „КПІ”
(Протокол № 10 від 16.06.2011 р.)
для студентів
технічних напрямів підготовки
Укладачі: Князєва Олена Миколаївна,канд. хім. наук, доц.
Потаскалов Вадим Анатолійович, канд. хім. наук, доц.
Відповідальний редактор: О.О. Андрійко докт. хім. наук, проф., зав. кафедри ЗНХ
Рецензенти:
Лисін В.І., канд. хім. наук, доц. кафедри електрохімічної енергетики та хімії
Київського національного університету технологій та дизайну КНУТД
Манчук Н.М., канд. техн. наук, доц. кафедри хімії і хімічної технології
інституту екологічної безпеки Національного авіаційного університету
 За редакцією укладачів
За редакцією укладачів
Електронне видання
ЗМІСТ
РОЗДІЛ I. БУДОВА ТА ВЛАСТИВОСТІ РЕЧОВИН.. 4
1 ОСНОВНІ ПОНЯТТЯ ХІМІЇ........................................................................................4
2. БУДОВА АТОМІВ.. 13
3. ХІМІЧНИЙ ЗВ’ЯЗОК. КРИСТАЛІЧНИЙ СТАН РЕЧОВИН............................. 23
4. КЛАСИ НЕОРГАНІЧНИХ СПОЛУК…………………………….………………....38
РОЗДІЛ II. ЗАКОНОМІРНОСТІ ПЕРЕБІГУ ХІМІЧНИХ РЕАКЦІЙ.. 46
5. ХІМІЧНА ТЕРМОДИНАМІКА.. 46
6. ХІМІЧНА КІНЕТИКА ТА РІВНОВАГА.. 57
РОЗДІЛ IІI. РОЗЧИНИ.. 76
7. ПРИРОДА РОЗЧИНІВ ТА СПОСОБИ ВИРАЖЕННЯ ЇХ СКЛАДУ.. 76
8. ВЛАСТИВОСТІ РОЗЧИНІВ НЕЕЛЕКТРОЛІТІВ.. 82
9. РОЗЧИНИ ЕЛЕКТРОЛІТІВ.. 88
РОЗДІЛ IV. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ. 107
РОЗДІЛ V. ЕЛЕКТРОХІМІЧНІ ПРОЦЕСИ.. 118
|
|
|
10. ГАЛЬВАНІЧНІ ЕЛЕМЕНТИ.. 118
11. НАПРЯМОК ПЕРЕБІГУ ОКИСНО-ВІДНОВНИХ РЕАКЦІЙ......................... 132
12. КОРОЗІЯ МЕТАЛІВ ТА СПЛАВІВ..................................................................... 136
13. ЕЛЕКТРОЛІЗ........................................................................................................... 146
ДОДАТОК............................................................................................................................... 155
СПИСОК ЛІТЕРАТУРИ........................................................................................................ 159
РОЗДІЛ І. БУДОВА ТА ВЛАСТИВОСТІ РЕЧОВИН
1. ОСНОВНІ ПОНЯТТЯ ХІМІЇ
Хімія вивчає: 1) якісний та кількісний склад речовини; 2) її будову; 3) фізичні властивості речовини (температури плавлення та кипіння, магнітні та спектральні властивості, густину, твердість, тепло- та електропровідність тощо); 4) хімічні властивості речовини, тобто її здатність взаємодіяти з іншими речовинами; 5) хімічні реакції, тобто процеси, внаслідок яких відбувається перетворення одних речовин на інші.
Речовина – це форма матерії, яка складається з частинок, що мають масу спокою, а саме з атомів, молекул та йонів.
Атом - це найменша хімічно неподільна частинка хімічного елемента.
Хімічний елемент - це вид атомів з однаковим зарядом ядра. Наприклад, хімічний елемент ферум Fe - це сукупність атомів із зарядом ядра "+26", хімічний елемент сульфур S - це сукупність атомів із зарядом ядра "+16". Хімічні властивості елемента визначаються електронною будовою атомів цього елемента.
Молекула - це найменша частинка речовини, яка здатна існувати самостійно, зберігаючи хімічні властивості речовини. Наприклад, молекули Н2 , СО2, Р4, S8, Не, C2H6, C6H6 тощо.
Але більшість твердих неорганічних речовин не мають молекулярної будови. Наприклад, кристал кварцу SiO2 складається з атомів сіліцію та оксигену, а кристал натрій хлориду NaCl - з йонів натрію Na + та хлорид-йонів СІ –, які з'єднані між собою у певному порядку. Такі неіснуючі частинки, як SiO2 та NaCl, що лише відображають склад речовини, називають умовними молекулами.
|
|
|
Будь-яка речовина складається з формульних одиниць (ФО), до яких належать реально існуючі атоми, молекули, йони та умовні молекули.
Проста речовина утворена з атомів одного хімічного елемента, а х імічна сполука - з атомів різних хімічних елементів. Наприклад, проста речовина водень складається з молекул Н2, утворених атомами тільки одного хімічного елемента – гідрогену. Проста речовина залізо Fe утворена тільки атомами феруму, а хімічна сполука кальцій оксид СаО – атомами різних хімічних елементів, а саме, атомами кальцію та оксигену.
Кількісні характеристики речовини
Масу речовини позначають буквою m(В), а абсолютну масу окремого атома або молекули – m0(В). Наприклад, маса порції водню дорівнює m(Н2)=10 г, а маса атома гідрогену m0(Н)=1,67·10 - 24 г, маса молекули водню m0(H2)=3,34·10 - 24г. Через те, що абсолютними масами атомів та молекул користуватись незручно, за одиницю маси атомів та молекул було прийнято атомну одиницю маси.
Атомна одиниця маси (а.о.м.) - це 1/12 частина маси атома ізотопу карбону 12С.
Відносна атомна маса хімічного елемента А r (В) – це відношення маси атома хімічного елемента до 1/12 маси атома карбону 12С.
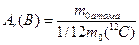 (1.1)
(1.1)
Відносна молекулярна маса речовини Mr(В) - це відношення маси молекули речовини до 1/12 маси атома карбону 12С.
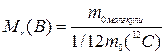 (1.2)
(1.2)
Відносні атомна та молекулярна маси – величини безрозмірні.
Наприклад, відносна атомна маса нітрогену дорівнює: A r (N)=14, відносна молекулярна маса карбон (ІV) оксиду: М r (СО 2) = Ar(C) + 2·Ar(O) = 44.
За одиницю кількості речовини прийнято моль. Моль - цe кількість речовини, що містить 6,02·1023 ФО, тобто атомів, молекул або йонів.
Стала Авогадро дорівнює: NA=6,02·1023 моль-1 і показує число ФО, що містяться в кількості речовини 1 моль, тобто число атомів, що містяться в 1 моль атомів, число молекул - в 1 моль молекул, число йонів - в 1 моль йонів.
Кількість речовини позначають буквою n(В), вимірюють у молях і розраховують за виразом:
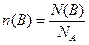 моль, (1.3)
моль, (1.3)
де N(B) – число формульних одиниць (ФО) у певній кількості речовини n(B).
Наприклад, n(СO2)=0,5моль.
Число молекул, що містяться у цій кількості речовини, відповідно до (1.3) дорівнює:
N(СO2) = n(СO2) · NA = 0,5 моль · 6,02·1023 моль–1 = 3,01·1023.
Молярна маса речовини М(В) (маса кількості речовини 1 моль) - це відношення маси речовини до її кількості:
|
|
|
 г/моль (1.4)
г/моль (1.4)
Молярна маса атомів – це виражена в грамах маса 1 моль атомів, що чисельно дорівнює відносній атомній масі, а молярна маса молекул – виражена в грамах маса 1 моль молекул речовини, що чисельно дорівнює відносній молекулярній масі. Наприклад, відносна атомна маса нітрогену дорівнює: Ar(N)=14, а молярна маса атомів нітрогену: M(N)=14 г/моль. Відносна молекулярна маса карбон(ІV) оксиду: Mr(CO2) =44, а молярна маса його молекул: М(СО2) =44 г/моль.
Знаючи молярну масу речовини та число ФО в кількості речовини 1 моль, можна розрахувати масу однієї ФО, тобто масу атома або молекули:
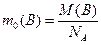 г (1.5)
г (1.5)
Так, маса атома нітрогену дорiвнює:  , маса молекули карбон(ІV) оксиду:
, маса молекули карбон(ІV) оксиду: 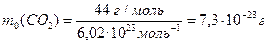 .
.
Молярний об'єм газу VМ (об'єм кількості газу 1 моль) – це відношення об'єму газу V(B) до його кількості:
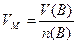 л/моль (1.6)
л/моль (1.6)
Молярний об'єм будь-якого газу за нормальних умов (н.у.) (Т=273К, р=101,3 кПа) дорівнює: VМ°=22,4 л/моль.
Вирази (1.3), (1.4) і (1.6) можна об`єднати, тоді матимемо:
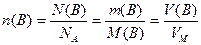 , (1.7)
, (1.7)
де m(B) – маса кількості речовини n(B), N(B) – число формульних одиниць, що містяться в цій кількості речовини, а V(B) – об`єм кількості газуватої речовини n(B).
З цього загального виразу можна знайти будь-яку з наведених величин.
Відносна густина одного газу В 1 за іншим В 2, яку позначають D(B2) - це відношення густини цих газів (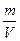 ), тобто відношення мас однакових об’ємів газів (V(B1)=V(B2)), отже і відношення їх молярних мас (молярної маси газу В1 до молярної маси газу В2):
), тобто відношення мас однакових об’ємів газів (V(B1)=V(B2)), отже і відношення їх молярних мас (молярної маси газу В1 до молярної маси газу В2):
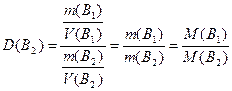 , (1.8)
, (1.8)
звідки M(B1)=М(В2)·D(B2). Якщо густину газу В1 визначають відносно водню (D(H2)), то молярна маса газу В1 дорівнює: М(В1)=М(H2)·D(H2)=2·D(H2). Якщо густину газу визначають відносно повітря (Dпов), то M(B1)=Mпов·Dпов, де Мпов - середня молярна маса повітря, що становить 29 г/моль.
Приклад 1. Маса газу об'ємом 5,6 л (н.у.) дорівнює 7 г. Обчисліть: а) молярну масу газу, б) його відносну молекулярну масу, в) масу молекули газу.
Розв'язання. а) Використовуючи співвідношення (1.7), знаходимо кількість речовини газу та його молярну масу:
 ,
,
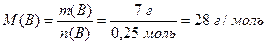
б) Оскільки відносна молекулярна мaca речовини чисельно дорівнює її молярній масі, але є безрозмірною величиною, то Mr(B) = 28.
|
|
|
в) За виразом (1.5) маса молекули газу дорівнює:
 .
.
Приклад 2: Кисень у лабораторії добувають під час термічного розкладу калій перманганату׃ 2KMnO4 = K2MnO4 + MnO2 + O2. Обчисліть кількість, масу та об`єм за н.у. кисню, що утворюється за нагрівання KMnO4 масою 474 г. Скільки молекул міститься в цій кількості кисню?
Розв'язання. Відносна молекулярна маса калій перманганату дорівнює сумі атомних мас елементів, що входять до складу молекули цієї речовини:
Mr(KMnO4) = Ar(K) + Ar(Mn) +4Ar(O) = 39,1 + 54,9 + 4·16 = 158
Молярна маса калій перманганату чисельно дорівнює його відносній молекулярній масі: M(KMnO4) = 158 г/моль
Визначимо кількість KMnO4 масою 474 г, використовуючи співвідношення (1.7):
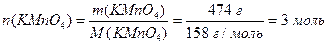
Згідно з рівнянням реакції з 2 моль KMnO4 за нагрівання утворюється 1 моль О2, а з 3 моль KMnO4 – відповідно 1,5 моль О2.
За виразом (1.7) знаходимо масу, об`єм за н.у. визначеної кількості кисню та число молекул, що містяться у цій кількості кисню:
m(O2) = n(O2) · M(O2) = 1,5 моль · 32 г/моль = 48 г,
V0(O2) = n(O2) · V0М = 1,5 моль · 22,4 л/моль = 33,6 л,
N(O2) = n(O2) · NA = 1,5 моль · 6,02·1023 моль–1 = 9,03·1023.
Приклад 3. Розрахуйте відносну густину карбон (ІV) оксиду за азотом.
Розв'язання. Згідно з виразом (1.8):
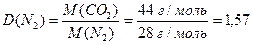 .
.
Еквівалент речовини - це умовна частинка, яка в z* разів менша за формульну одиницю (ФО), і позначається  . Число z* називається числом еквівалентності. У формульній одиниці міститься z* еквівалентів. Якщо z*=1, тоді еквівалентом речовини є її формульна одиниця.
. Число z* називається числом еквівалентності. У формульній одиниці міститься z* еквівалентів. Якщо z*=1, тоді еквівалентом речовини є її формульна одиниця.
Для хімічного елемента формульною одиницею є його атом, a z* дорівнює валентності елемента у сполуці. Отже, еквівалент елемента – це атом або його частка, що припадає на одиницю валентності елемента.
Для хімічної сполуки формульною одиницею є її молекула.
Кількість еквівалентів позначають буквою 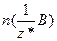 і вимірюють у молях, а молярну масу еквівалентів речовини, тобто масу кількості еквівалентів 1 моль, позначають
і вимірюють у молях, а молярну масу еквівалентів речовини, тобто масу кількості еквівалентів 1 моль, позначають 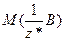 і вимірюють у г/моль.
і вимірюють у г/моль.
Співвідношення між кількістю еквівалентів та молярною масою еквівалентів речовини має вигляд:
 , або
, або  (1.9)
(1.9)
Якщо речовина газувата, то користуються молярним об'ємом еквівалентів газу, тобто об’ємом кількості еквівалентів 1 моль 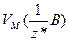 , який вимірюють у л/моль:
, який вимірюють у л/моль:
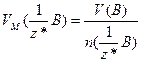 , або
, або  (1.10)
(1.10)
Закон єквівалентів: Маси речовин, що беруть участь у хімічних реакціях, відносяться між собою, як молярні маси іх еквівалентів.
 , або
, або  , (1.11)
, (1.11)
звідки,  (1.12)
(1.12)
Отже, кількість еквівалентів всіх учасників реакції дорівнює одна одній, а молярні маси еквівалентів – це маси кількості еквівалентів 1 моль, які без залишку взаємодіють між собою.
Якщо речовина газувата, то у виразі (1.11) замість молярної маси еквівалентів використовують молярний об'єм еквівалентів цієї речовини:
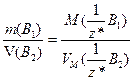 (1.13)
(1.13)
Молярна маса еквівалентів хімічного елемента дорівнює молярній масі елемента, поділеній на число еквівалентності:
 (1.14)
(1.14)
За законом еквівалентів 1 моль еквівалентів одного елемента В1 сполучаеться з 1 моль еквівалентів іншого елемента В2 і при цьому утворюється 1 моль еквівалентів хімічної сполуки. Тому молярна маса еквівалентів сполуки дорівнює сумі молярних мас еквівалентів елементів,з атомів яких складається молекула сполуки:
 (1.15)
(1.15)
Оскільки проста речовина утворюється з атомів одного хімічного елемента, тому молярна маса еквівалентів простої речовини дорівнює молярній масі еквівалентів цього хімічного елемента, а молярний об`єм еквівалентів простої газуватої речовини дорівнює молярному об`єму еквівалентів хімічного елемента.
Приклад 4. Чому дорівнює: а) еквівалент і молярна маса еквівалентів хімічних елементів – гідрогену та оксигену; б) молярна маса еквівалентів простих речовин – водню (Н2) та кисню (О2); в) молярний об’єм еквівалентів водню та кисню; г) молярний об’єм еквівалентів гідрогену та оксигену?
Розв’язання.
а) Валентність гідрогену дорівнює I, а оксигену – II, число еквівалентності z* цих елементів становить відповідно 1 та 2.
Тому еквівалентом гідрогену є його атом (Н), а еквівалентом оксигену є 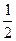 атома оксигену (
атома оксигену (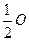 ).
).
За виразом (1.14) молярна маса еквівалентів гідрогену дорівнює: 
 ,
,
а молярна маса еквівалентів оксигену дорівнює:
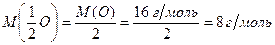
б) Оскільки молярна маса еквівалентів простої речовини дорівнює молярній масі еквівалентів хімічного елемента, то молярна маса еквівалентів водню становить 1 г/моль, а молярна маса еквівалентів кисню – 8 г/моль.
в) Згідно з співвідношенням (1.7) визначимо кількості простих речовин водню та кисню, маса яких дорівнює відповідно молярній масі еквівалентів водню та молярній масі еквівалентів кисню, а об`єм – молярним об`ємам еквівалентів цих речовин:
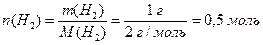 ,
,
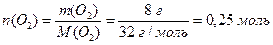 .
.
Знаходимо об`єм (н.у.) розрахованих кількостей водню та кисню (1.7):
V0(Н2) = n(Н2) · V0М = 0,5 моль · 22,4 л/моль = 11,2 л,
V0(O2) = n(O2) · V0М = 0,25 моль · 22,4 л/моль = 5,6 л
Отже, молярний об`єм еквівалентів водню дорівнює 11,2 л/моль, а молярний об`єм еквівалентів кисню – 5,6 л/моль.
г) Оскільки молярний об`єм еквівалентів хімічного елемента дорівнює молярному об`єму еквівалентів простої речовини, яка складається з атомів цього елемента, то молярний об’єм еквівалентів гідрогену V0М(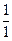 Н) становить 11,2 л/моль, а молярний об’єм еквівалентів оксигену V0М(
Н) становить 11,2 л/моль, а молярний об’єм еквівалентів оксигену V0М( O) – 5,6 л/моль.
O) – 5,6 л/моль.
Приклад 5. Під час згоряння металу масою 5 г утворюється метал оксид масою 9,44 г, в якому валентність металу дорівнює трьом. Розрахуйте а) еквівалент металу, б) молярну масу еквівалентів металу, в) молярну масу еквівалентів метал оксиду, г) молярну масу металу. Визначте, що це за метал.
Розв'язання.
а) Оскільки число еквівалентності металу співпадає з його валентністю, то еквівалентом металу є 1/3 його атома (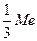 ).
).
б) За виразом (1.9) обчислюємо кількість еквівалентів оксигену, що знаходиться в утвореному оксиді, враховуючи, що маса оксигену дорівнює різниці між масою оксиду та масою металу: m(O) = 9,44 г – 5 г = 4,44 г;
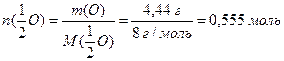
Кількість еквівалентів металу дорівнює кількості еквівалентів оксигену (1.12): 
Розрахуємо молярну масу еквівалентів металу (1.9):

в) Молярна маса еквівалентів метал оксиду дорівнює сумі молярних мас еквівалентів металу та оксигену (1.15):
 .
.
г) Обчислюємо молярну масу металу (1.14):
 , тому
, тому 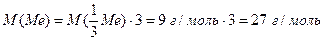
За Періодичною системою елементів визначаємо, що це алюміній.
Приклад 6. Визначте а) молярну масу еквівалентів стануму, б) його валентність в станум хлориді SnCln з масовою часткою стануму ω(Sn)=45,56 % (0,4556 в частках від одиниці). Наведіть формулу сполуки.
Розв'язання. а) Масова частка елемента в сполуці – це відношення його маси до маси сполуки. Отже, масова частка стануму в станум хлориді дорівнює:
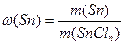
Звідки: m(Sn) = ω(Sn) · m(SnCln) =0,4556 · m(SnCln)
Сума масових часток всіх елементів в сполуці становить 1, тому масова частка хлору та його маса дорівнюють:
ω(Cl) = 1 – ω(Sn) = 1 – 0,4556 = 0,5444,
m(Cl) = ω(Cl) · m(SnCln) =0,5444 · m(SnCln)
Елемент хлор в хлоридах є одновалентним, тобто число еквівалентності z*(Cl)=1, тому молярна маса еквівалентів хлору дорівнює:
 г/моль.
г/моль.
За законом еквівалентів (1.11) розрахуємо молярну масу еквівалентів стануму:
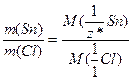


б) Число еквівалентності стануму в станум хлориді визначається за виразом (1.14):

Оскільки валентність елемента в сполуці співпадає з його числом еквівалентності, то валентність стануму в станум хлориді становить IV. Формула сполуки – SnCl4.
Приклад 7. Під час розчинення заліза масою 7 г у хлоридній кислоті виділяється водень об'ємом 2,8 л (н.у.). Розрахуйте а) молярну масу еквівалентів феруму, б) валентність феруму та його еквівалент в солі, яка утворилась. Наведіть формулу солі.
Розв'язання.
а) Розрахувати молярну масу еквівалентів феруму можна двома способами:
I спосіб. За законом еквівалентів (1.13) розрахуємо молярну масу еквівалентів феруму, враховуючи, що молярний об’єм еквівалентів водню дорівнює молярному об’єму еквівалентів гідрогену, тобто становить 11,2 л/моль:
 ;
;  ,
,

ІI спосіб. Кількість еквівалентів водню, виділеного внаслідок розчинення заліза у кислоті, дорівнює кількості еквівалентів гідрогену, витісненого з кислоти металом, а саме (1.10):

За виразом (1.12): 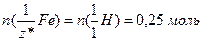 .
.
Обчислимо молярну масу еквівалентів феруму (1.9):

б) Визначимо число еквівалентності феруму в солі (1.14):
 ;
; 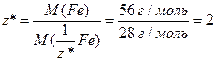
Валентність феруму в солі дорівнює ІІ, його еквівалентом є 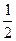 атома (
атома (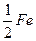 ), а формула утвореної солі – FeCl2.
), а формула утвореної солі – FeCl2.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 495; Нарушение авторских прав?; Мы поможем в написании вашей работы!