
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реальные газы. Водяной пар. Влажный воздух
Контрольные задания
2.1. Разрежение в газоходе парового котла, измеряемое тягомером,равно Рмм вод. ст. Определить абсолютное давление газов, еслипоказание барометра 730 мм рт. ст., и выразить его в МПа.
2.2 В закрытом сосуде объемом V находится воздух при давлении Р1=0,8 МПа и температуре t1=200С. Какое количество теплоты необходимо подвести для того, чтобы температура воздуха поднялась до t2=1200С?
2.3 Какое количество теплоты необходимо затратить, чтобы нагретьV м3 воздуха при постоянном избыточном давлении P = 2 ат. от t1 = 120°Cдо t2 = 450°C? Какую работу при этом совершит воздух?
Атмосферное давление принять равным 750 мм рт. ст.
| № задачи | Значение | № варианта | |||||||||
| 2.1 | Р, мм вод. ст. | ||||||||||
| 2.2 | V, л | ||||||||||
| 2.3 | V, м3 | 2,2 | 2,4 | 2,6 | 2,8 | 3,2 | 3,4 | 3,6 | 3,8 |
Реальные газы отличаются от идеальных газов тем, что молекулы этих газов имеют конечные собственные объемы и связаны между собой силами взаимодействия, которые имеют электромагнитную и квантовую природу. Эти силы существуют между любыми молекулами при любых условиях и уменьшаются с увеличением расстояния между молекулами. При сближении молекул на малые расстояния силы притяжения резко уменьшаются и переходят в силы отталкивания, достигающие очень больших значений.
Из-за наличия сил взаимодействия между молекулами и конечности их объема законы идеальных газов, ни при каких условиях, не могут быть строго применимы к реальным газам.
При практических расчетах различных свойств реальных газов находит широкое применение величина отношения 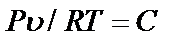 , которая получила название коэффициента сжимаемости. (Эта величина не является коэффициентом термодинамического сжатия).
, которая получила название коэффициента сжимаемости. (Эта величина не является коэффициентом термодинамического сжатия).
Уравнение состояния Ван-дер-Ваальса является одной из первых попыток аналитически описать свойства реальных газов. Это уравнение наглядно показывает качественные особенности реальных газов и их отличие от идеальных.
Чем дальше состояние газа находится от области перехода в жидкость и чем больше расстояние между молекулами, тем меньше силы взаимодействия между ними и тем ближе состояние реального газа к идеальному. И наоборот, чем ближе состояние газа к области жидкости, тем силы взаимодействия больше и тем значительнее его отклонение от свойств идеального газа. Таким образом, при изучении свойств реальных газов необходимо учитывать силы взаимодействия между молекулами и объем самих молекул.
В первом приближении Ван-дер-Ваальс ввел в своем уравнении две поправки, которые учитывают отклонение реального газа от идеального.
Рассмотрим первую поправку, зависящую от объема самих молекул.
Уравнение Клапейрона можно представить в виде:
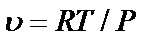
При увеличении давления объем будет υ уменьшаться, и если  то
то  . Это полностью согласуется с определением идеального газа, в котором молекулы занимают бесконечно малый объем.
. Это полностью согласуется с определением идеального газа, в котором молекулы занимают бесконечно малый объем.
Если же рассматривать реальный газ, у которого молекулы занимают конечный объем υмол, и учитывать объем зазоров между молекуламиυзаз при их полной упаковке, то свободный объем для движения молекул будет равен:  где
где  .
.
Величина b – тот наименьший объем, до которого можно сжать газ.
При этих условиях уравнение Клапейрона принимает другой вид:
 .
.
Вторая поправка, вводимая в уравнение состояния, учитывает влияние сил взаимодействия между молекулами.
В идеальном газе молекулы практически свободны в своем движении и удары о стенку сосуда ничем не ограничены, так как сил взаимодействия между молекулами не имеется.
В реальном газе при наличии сил взаимодействия между молекулами сила ударов о стенку сосуда будет меньше, вследствие того что все молекулы у стенки сосуда притягиваются соседними молекулами внутрь сосуда. Следовательно, и давление, оказываемое реальным газом по сравнению сидеальным, будет меньше на величину  , которая представляет поправку на давление, учитывающую силы взаимодействия между молекулами.Эта поправка
, которая представляет поправку на давление, учитывающую силы взаимодействия между молекулами.Эта поправка 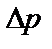 прямо пропорциональна как числу притягиваемых, так и числу притягивающих молекул, или прямо пропорциональна квадрату плотности газа, или обратно пропорциональна квадрату его удельного объема:
прямо пропорциональна как числу притягиваемых, так и числу притягивающих молекул, или прямо пропорциональна квадрату плотности газа, или обратно пропорциональна квадрату его удельного объема:
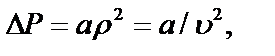
где а – коэффициент пропорциональности, принимающий для каждого газа определенное числовое значение, не зависящее от параметров состояния.
C учетом этого уравнение Ван-дер-Ваальса принимает вид:

|
|
Дата добавления: 2017-01-14; Просмотров: 1793; Нарушение авторских прав?; Мы поможем в написании вашей работы!