
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Методика визначення сульфат-іонів
|
|
|
|
Кількісне визначення сульфат-іонів
Кількісно сульфат-іони визначають комплексонометричним методом за допомогою трилону Б. Сутність методу полягає в тому, що до аналізованої води додають надлишок іонів Ba2+ – стандартний розчин BaCl2 і MgCl2(10 г 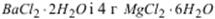 в 1 л води). Частина іонів барію зв’язує сульфат-іони в нерозчинний осад BaSO4. Іони Ba2+, що залишилися в розчині, відтитровують стандартним розчином трилону Б, з яким іони барію утворюють комплексні сполуки. Вміст сульфат-іонів розраховують за різницею витрат трилону Б, який йде на зв’язування іонів барію до і після осаджування сульфат-іонів. Оскільки досліджувана вода завжди містить іони Ca2+ і Mg2+, які також утворюють комплексні сполуки з трилоном Б, то на присутність цих іонів потрібно ввести відповідні поправки.
в 1 л води). Частина іонів барію зв’язує сульфат-іони в нерозчинний осад BaSO4. Іони Ba2+, що залишилися в розчині, відтитровують стандартним розчином трилону Б, з яким іони барію утворюють комплексні сполуки. Вміст сульфат-іонів розраховують за різницею витрат трилону Б, який йде на зв’язування іонів барію до і після осаджування сульфат-іонів. Оскільки досліджувана вода завжди містить іони Ca2+ і Mg2+, які також утворюють комплексні сполуки з трилоном Б, то на присутність цих іонів потрібно ввести відповідні поправки.
Дослід 1. У конічну колбу місткістю 200–250 мл піпеткою набирають 50 мл досліджуваної води і визначають загальний вміст іонів Ca2+ і Mg2+ у воді (загальна твердість води). До проби води циліндром додають 5 мл амонійного буферного розчину (для створення і підтримки рН~10) і 10–15 мг сухої суміші кристалів індикатора хромогену чорного з NaCl. Отриманий розчин титрують 0,05 н. розчином трилону Б (fекв=1/2) від вишнево-червоного до синього забарвлення і занотовують до журналу об’єм трилону Б (V1), витрачений на титрування проби води.
Дослід 2 (холостий дослід). У конічну колбу на 200–250 мл піпеткою набирають 50 мл дистильованої води і піпеткою додають 1 мл стандартного розчину BaCl2, що містить іони магнію. Іони магнію потрібні для більш точного встановлення точки еквівалентності. Далі циліндром додають 5 мл амонійного буферного розчину і 10–15 мг індикатора хромогену чорного з NaCl. Отриманий розчин титрують 0,05 н. розчином трилону Б (fекв=1/2) від вишневочервоного до синього забарвлення і занотовують до журналу об’єм трилону Б (V2), витрачений на титрування холостої проби води.
|
|
|
Дослід 3. У конічну колбу на 200–250 мл піпеткою набирають 50 мл досліджуваної води, додають 2–3 краплі розчину індикатора метилового червоного (рТ=5,5) і підкисляють пробу води 0,1 М розчином хлоридної кислоти до появи червоного забарвлення. Колбу встановлюють на газовий пальник і кип’ятять 3–5 хв. від початку закипання. При цьому спостерігають, щоб протягом усього процесу кип’ятіння колір розчину залишався червоним. Якщо він стане блідим або жовтим, потрібно додати ще декілька краплин 0,1 М розчину HCl. Присутність HCl потрібна для того, щоб гідрокарбонати кальцію та магнію перевести у добре розчинні хлориди кальцію та магнію (для збереження іонів кальцію та магнію), а кип’ятіння – для інтенсивного видалення CO2, який утворюється в результаті реакцій:
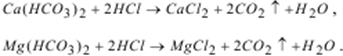
Після кип’ятіння до розчину додають 1 мл стандартного розчину BaCl2, що містить іони магнію, і кип’ятять ще 10–15 сек. для більш повного осадження іонів SO42−іонами Ba2+.Далі пробу води охолоджують 10–15 хв. і нейтралізують 0,1 М розчином NaOH до появи жовтого забарвлення. Потім до проби води циліндром додають 5 мл амонійного буферного розчину і 10–15 мг індикатора хромогену чорного з NaCl. Отриманий розчин титрують 0,05 н. розчином трилону Б (fекв=1/2) від вишнево-червоного до синього забарвлення і занотовують до журналу об’єм трилону Б (V3), витрачений на титрування проби води.
Вміст сульфат–іонів (Х) розраховують за формулою:

де С – молярна концентрація еквівалента трилону Б (fекв=1/2), моль/л;
V1 – об’єм трилону Б, який пішов на титрування іонів Ca2+ і Mg2+ (дослід1), мл;
V2 – об’єм трилону Б, який пішов на титрування іонів Ba2+ і Mg2+ (дослід2), мл;
V3 – об’єм трилону Б, який пішов на титрування іонів Ca2+, Mg2+ та надлишкового Ba2+, що не зв’язався з сульфат–іонами (дослід 3), мл;
M SO42− (1/2) – молярна маса еквівалента іонів SO42−, що дорівнює 48 г/моль;
V4 – об’єм проби води, мл.
|
|
|
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 442; Нарушение авторских прав?; Мы поможем в написании вашей работы!