
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Загальна характеристика методу. Приготування робочого розчину перманганату калію
|
|
|
|
Лабораторна робота №21
Тема: Пермаганатометрія. Визначення заліза.
Теоретичні питання:
1. Загальна характеристика методу. Приготування робочого розчину перманганату калію.
2. Визначення заліза.
Загальна характеристика. Перманганатометрія — метод титриметричного аналізу, в якому речовину визначають титруванням перманганатом калію. Титрування розчином перманганату застосовують для визначення багатьох відновників: заліза (II) і олова (II), ванадію (IV) і урану (IV), марганцю (II) тощо. Деякі речовини органічного походження також здатні окислюватись розчином перманганату калію. До них належать, наприклад, спирти, оксикислоти, альдегіди, ненасичені кислоти тощо. Залежно від умов перманганат калію відновлюється до марганцю (II) або марганцю (IV). У кислому середовищі реакція протікає за таким рівнянням:

тобто в результаті реакції марганець (VII) відновлюється до марганцю (II)
При меншій концентрації водневих іонів у слабкокислих або лужних розчинах перманганат відновлюється до марганцю (IV), який виділяється з розчину у вигляді нерозчинного осаду оксиду марганцю (IV):
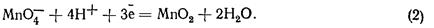
Осад оксиду марганцю (IV) утруднює спостереження точки еквівалентності і робить визначення не досить зручним. Тому головне значення має титрування відновників за першою схемою. Титрування в слабкокислому або лужному розчині застосовують тільки для визначення марганцю (II) і в деяких інших спеціальних випадках, які тут не розглядатимемо.
Перманганат калію є сильним окислювачем: його нормальний окислювально-відновний потенціал при відновленні до марганцю (II) дорівнює 1,52 В. Це дає змогу визначати за допомогою титрування перманганатом не тільки сильні відновники, якими є, наприклад, іони заліза (II), олова (II) або титану (III), а також відновники середньої сили, наприклад ванадій (IV) тощо. Але те, що перманганат має високий окислювально-відновний потенціал, призводить у ряді випадків до певних ускладнень. Так, при титруванні солянокислих розчинів треба вживати заходів, щоб уникнути побічної реакції — окислення соляної кислоти перманганатом з виділенням вільного хлору.
|
|
|
Перманганат калію не має властивостей вихідної речовини; препарат завжди має більшу або меншу кількість домішок оксиду марганцю (IV), яких важко позбутися. Крім того, концентрація розчину перманганату калію з часом змінюється внаслідок відновлення під впливом світла, невеликих кількостей органічних речовин, які попадають у розчин у вигляді пилу, тощо. З цих причин розчини перманганату калію точно відомої концентрації не можна приготовляти безпосередньо з наважки, узятої на аналітичних терезах. Потрібну кількість препарату відважують звичайно на технічних терезах і приготовляють розчин приблизної концентрації. Точну концентрацію розчину встановлюють за іншими вихідними речовинами.
Для кількісних визначень найзручніше користуватися децинормальними розчинами перманганату; розчини більшої концентрації не застосовують через обмежену розчинність КМnO4 у воді. Більш розведені розчини (наприклад, сантинормальні) нестійкі і швидко розкладаються внаслідок процесу відновлення.
З рівняння (1) видно, що у відновленні перманганат-іонy бере участь п'ять електронів. Отже, еквівалент перманганату калію дорівнює 1/5 частині молекулярної маси.
При титруванні розчином перманганату звичайно не застосовують ніяких спеціальних індикаторів. Точку еквівалентності встановлюють за рожевим забарвленням, яке виникає від невеликого надлишку добавленого розчину КМnO4; отже, індикатором є сам робочий розчин. Помилку титрування, яка виникає при такому способі встановлений точки еквівалентності, легко визначити за допомогою холостої проби.
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 513; Нарушение авторских прав?; Мы поможем в написании вашей работы!