
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Встановлення нормальності розчину перманганату за щавлевою кислотою
|
|
|
|
Реакція між перманганатом калію і щавлевою кислотою відбувається за таким рівнянням:
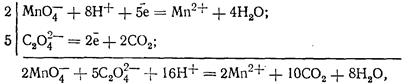
або в молекулярному вигляді
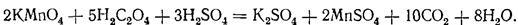
Наведене вище рівняння відображає сумарний процес: насправді реакція значно складніша, вона має ряд проміжних стадій. Це видно з того, що при добавлянні перших краплин розчину перманганату до підкисленого сірчаною кислотою розчину щавлевої кислоти реакція відбувається не відразу: розчин тривалий час залишається забарвленим у рожевий колір. Нагрівання прискорює реакцію, але і в цьому випадку знебарвлення перших краплин перманганату настає через досить довгий час. Наступні порції робочого розчину реагують швидше, і згодом швидкість реакції збільшується настільки, що навіть значні кількості розчину KMnO4 відновлюються щавлевою кислотою вмить. Дослідження показали, що каталізатором у цій реакції є іони марганцю (II) і що збільшення їх концентрації в розчині значно прискорює реакцію. Справді, якщо до розчину щавлевої кислоти спочатку добавити певну кількість розчину сульфату чи хлориду марганцю, то навіть перші краплини робочого розчину знебарвлюються досить швидко. Основні проміжні стадії реакції можна схематично показати так:

Реакція між перманганатом і щавлевою кислотою безпосередньо не відбувається або відбувається дуже повільно. Навпаки, швидкість реакції між перманганатом і іонами марганцю (II), в результаті якої утворюється МnO2 досить велика; найшвидше взаємодіють МnO2 і Н2С2O4. Тому зрозуміло, що збільшення концентрації іонів марганцю (II)" в розчині значно впливає на швидкість сумарної реакції відновлення перманганату щавлевою кислотою.
Хід визначення. Відбирають піпеткою 20 або 25 мл 0,1 н. розчину щавлевої кислоти і переносять у конічну колбу місткістю 200 мл. Добавляють до нього 15—20 мл розчину сірчаної кислоти (1: 4) і нагрівають на електричній плитці або газовому пальнику до температури 80—90° С. При цьому треба стежити, щоб стінки колби вище рівня рідини надто не перегрівались; це може призвести до утворення на стінках сухої кірочки щавлевої кислоти і до її розкладання під впливом високої температури:
|
|
|

Замість нагрівання на плитці чи пальнику можна до розчину щавлевої кислоти долити певну кількість киплячої води з таким розрахунком, щоб температура суміші в колбі після цього дорівнювала приблизно 70—80" С.
До гарячого розчину щавлевої кислоти добавляють з бюретки кілька краплин розчину перманганату і чекають, поки зникне рожеве забарвлення. Після цього добавляють наступні порції перманганату, щоразу чекаючи знебарвлення розчину. Після добавляння 2—3 мл розчину перманганату титрування відбувається швидше і робочий розчин можна добавляти більшими порціями. Наприкінці титрування розчин забарвлюється в рожевий колір, який не зникає довгий час. Це є ознакою кінця титрування. Визначення треба повторити з новими кількостями розчину щавлевої кислоти ще 2-3 рази, причому розходження між окремими паралельними пробами не повинно перевищувати 0,02—0,03 мл. Відлічувати об'єм робочого розчину, витраченого на титрування, зручно за верхнім меніском рідини в бюретці.
Нормальність розчину перманганату обчислюють за рівнянням

де N — нормальність; V — об'єм розчинів перманганату калію і щавлевої кислоти.
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 273; Нарушение авторских прав?; Мы поможем в написании вашей работы!