
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Визначення заліза
|
|
|
|
Суть методу. Розчин солі заліза (II) титрують у кислому середовищі робочим розчином перманганату калію. Реакція відбувається за такими іонними рівняннями:

або в молекулярному вигляді
 Метод застосовують головним чином для визначення заліза в рудах, силікатах і шлаках з великим вмістом заліза. Ці матеріали для переведення заліза в розчин безпосередньо обробляють кислотами, а ті, що не розчиняються в кислотах, спочатку сплавляють з карбонатом натрію або іншими речовинами. Після такої обробки утворюється розчин хлориду заліза (III). Тому перед титруванням розчином перманганату залізо (III) відновлюють до заліза (II). Для відновлення можна застосовувати гази, розчини відновників або тверді речовини. Розглянемо коротко основні способи відновлення.
Метод застосовують головним чином для визначення заліза в рудах, силікатах і шлаках з великим вмістом заліза. Ці матеріали для переведення заліза в розчин безпосередньо обробляють кислотами, а ті, що не розчиняються в кислотах, спочатку сплавляють з карбонатом натрію або іншими речовинами. Після такої обробки утворюється розчин хлориду заліза (III). Тому перед титруванням розчином перманганату залізо (III) відновлюють до заліза (II). Для відновлення можна застосовувати гази, розчини відновників або тверді речовини. Розглянемо коротко основні способи відновлення.
Відновлення газами. Для відновлення заліза можна застосовувати SO2 або H2S. Гази пропускають у розчин доти, поки якісна проба покаже відсутність іонів заліза (III). Реакції проходять за такими рівняннями:

або
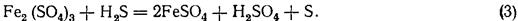
Відновлення газами має певні незручності. Роботу треба проводити під доброю тягою, крім того, установлення моменту повного відновлення потребує виконання спеціальних якісних дослідів, які іноді доводиться робити кілька разів. Нарешті, перед титруванням перманганатом треба позбутись надлишку введеного в розчин газу, для чого розчин тривалий час кип'ятять. З цих причин відновлення газами застосовують досить рідко.
Відновлення розчинами відновників. Найчастіше відновлення проводять розчином хлориду олова (II):

Можна також використовувати розчини хлоридів титану (III) чи хрому (II) та інші сильні відновники. Незручність цих методів полягає в тому, що перед титруванням заліза перманганатом треба окислювати надлишок введеного відновника так, щоб усе залізо залишилося в двовалентній формі; вибір окислювача для цього — справа досить важка.
|
|
|
Відновлення твердими відновниками. Як тверді відновники застосовують метали в подрібненому стані або їх амальгами. Найчастіше для цього використовують металічні цинк або кадмій:

При відновленні лише частина металічного цинку витрачається на реакцію з залізом (III). Більша частина його витрачається на побічну реакцію з кислотою, яка завжди є в розчині:

Отже, багато металу витрачається марно. Крім того, кислотність розчину внаслідок реакції (6) зменшується, що може призвести до гідролізу іонів заліза (III) з утворенням важкорозчинних основних солей. Кращі наслідки дає застосування амальгамованих металів або амальгам. У першому випадку метал обробляють розчином нітрату ртуті; при цьому метал покривається тонким шаром металічної ртуті, яка частково утворює амальгаму. У другому випадку металічні цинк або кадмій розчиняють у ртуті і рідку амальгаму використовують для відновлення. Метал в амальгамі повільніше реагує з кислотою, ніж чистий метал, і тому витрачається майже повністю на відновлення іонів заліза (III); при цьому побічна реакція між металом і кислотою майже не відбувається.
Нижче докладно розглянуто визначення заліза за методом Рейнгарда, в якому відновником є розчин хлориду олова (II) SnCl2.
Визначення заліза в руді. Переведення проби в розчин. Метод Рейнгарда застосовується головним чином для визначення заліза в рудах. Залізні руди є оксидами заліза різного складу. Для розчинення залізних руд найкраще брати концентровану соляну кислоту; при цьому утворюється малодисоційований хлорид заліза (III), внаслідок чого полегшується взаємодія оксиду заліза з кислотою:

Після обробки руди кислотою іноді залишаються нерозчинні сполуки кремнієвої кислоти білого або світло-сірого кольору. У цьому випадку не-розчинний залишок відфільтровують і залишають без уваги. Жовтий або бурий колір нерозчинного залишку свідчить при присутність у ньому більшої або меншої кількості заліза. Такий залишок піддають додатковій обробці, щоб перевести все залізо в розчин. Способи такої обробки розглянуто в спеціальних посібниках з аналітичної хімії.
|
|
|
Відновлення заліза (III) хлоридом олова (II). До розчину хлориду заліза (III) доливають розчин хлориду олова (II). При цьому відбувається така реакція:

Відновлення треба провести так, щоб надлишок введеного SnCl2 був дуже незначним, бо великий надлишок SnCl2 значно ускладнює дальшу ро-боту. Тому розчин SnCl2 добавляють обережно, окремими краплинами доти, поки зникне жовте забарвлення хлориду заліза (III) (розчин FeCl2 без-барвний). Інтенсивність жовтого забарвлення значно більша при високій температурі. Тому розчин FeCl3 перед добавлянням SnCl2 нагрівають майже до кипіння. При відновленні гарячого розчину легше помітити момент, коли кількість добавленого SnCl2 еквівалентна кількості хлорида заліза (III). Незважаючи на те що кінець відновлення помітити досить легко, розчин відновленого заліза звичайно містить невеликий надлишок SnCl2. Надлишок SnCl2 окислюють за допомогою розчину сулеми:

При цьому виділяється білий шовковистий осад хлориду ртуті (І). Можлива також побічна реакція утворення металічної ртуті:

В останньому випадку перманганат витрачається не лише на взаємодію з іонами заліза (II), а й на окислення металічної ртуті, яка виділяється прицьому у вигляді чорного осаду. Проба в такому випадку непридатна для дальшого аналізу. Сулема відновлюється до металічної ртуті звичайно при великому надлишку введеного SnCl2 або при надто повільному доливанні розчину хлориду ртуті (II), коли створюється місцевий надлишок SnCl2, який сприяє проходженню реакції (9). Відновленню іонів ртуті (II) до металу сприяє також висока температура розчину. Тому розчин хлориду заліза (III) перед добавлянням розчину сулеми треба охолоджувати.
Титрування іонів заліза (II) розчином перманганату. При титруванні розчину солі заліза перманганатом концентрація іонів заліза (III) збільшується і розчин поступово забарвлюється в жовтий колір. У точці еквівалентності забарвлення переходить від жовтого до рожевого; цей перехід наше око сприймає не досить чітко. Тому перед титруванням до розчину добавляють фосфорну кислоту, що реагує з іонами заліза (III) за рівнянням
|
|
|
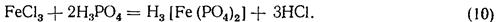
Фосфатний комплекс заліза безбарвний, тому в цьому випадку точка еквівалентності визначається дуже точно (перехід забарвлення від безбарвного до рожевого).
Перманганат калію не реагує з розведеним розчином соляної кислоти. Первинна реакція окислення заліза зумовлює вторинну реакцію окислення іонів хлору:

За теорією Маншо це пояснюється утворенням проміжної сполуки заліза (V):

Остання є сильнішим окислювачем, ніж перманганат, і здатна окислювати соляну кислоту з виділенням вільного хлору:

Отже, титрування заліза перманганатом у солянокислому розчині без додержування спеціальних заходів для усунення вторинної реакції дає неправильні результати. Виділенню хлору можна запобігти добавлянням розчину сульфату марганцю. У цьому випадку, як уже зазначалося (§ 24), проміжна сполука заліза (V) швидше реагує з іонами марганцю (II), ніж з іонами хлору:
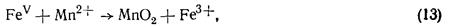
тому помітного виділення хлору не спостерігається.
Оксид марганцю (IV) витрачається на окислення іонів заліза (II); з другого боку, МnO2 в розведених солянокислих розчинах нездатний окислювати хлоридів з виділенням вільного хлору. Крім того, введення іонів Mn (II)знижує окислювально-відновний потенціал системи МnO4/Мn(II).Таким чином, у присутності іонів марганцю (II) перманганат калію витрачається тількина окислення іонів заліза (II) і побічних реакцій не буває. Щоб запобігти зазначеній вище побічній реакції, а також щоб краще було спостерігати точку еквівалентності, до розчину іонів заліза (II) перед титруванням добавляють так звану захисну суміш, до складу якої входять розчини фосфорної і сірчаної кислот, а також розчин сульфату марганцю1.
Хід визначення. Наважку залізної руди беруть з такого розрахунку, щоб приготувати приблизно 0,1 н. розчин хлориду заліза (III). Орієнтовну величину наважки оксиду заліза (III), яку треба взяти для цього, можна визначити, виходячи з таких міркувань. Еквівалент Fe2O3 в цій реакції дорівнює половині молекулярної маси. Отже, щоб приготувати 100 мл 0,1 н.розчину, треба взяти 0,8 г Fe2O3. Беручи до уваги,що в руді є й інші складові частини (вода, кремнієва кислота та ін.) і що середній вміст заліза в руді звичайно буває близько 50—60%, величину наважки подвоюють.1,2—1,5 г залізної руди відважують на аналітичних терезах з точністю до 0,1 мг і переносять з годинникового скла в стакан місткістю 250— 300 мл. Наважку заливають 15—20 мл концентрованої соляної кислоти, стакан накривають годинниковим склом і нагрівають до повного розчинення наважки або доти, поки нерозчинний залишок стане білим чи трохи жовтуватим. Розчин з осадом переносять у вимірювальну колбу на 100 мл і роз-водять водою до риски, після чого вміст колби старанно перемішують.25 мл приблизно 0,1 н. розчину хлоридів заліза (III) переносять піпеткою в конічну колбу на 200—250 мл (нерозчинний залишок не заважає визначенню). Розчин у колбі нагрівають майже до кипіння, причому він набуває інтенсивно-жовтого кольору. До гарячого розчину добавляють з бюретки або піпетки краплинами розчин хлориду олова (II) до зникнення жовтого забарвлення, після чого добавляють ще 1—2 краплини надлишку розчину SnCl2*. Розчин хлориду заліза (III) охолоджують проточною водою, після чого доливають 10 мл 5%-го розчину сулеми (при цьому повинен виділятись білий шовковистий осад Hg2Cl2). Добавляють до розчину 10— 15 мл захисної суміші, розводять його водою приблизно в 2 рази і титрують робочим розчином перманганату калію до рожевого забарвлення, яке не зникає протягом 1—2 хв (надлишок введеного перманганату з часом витрачається на окислення каломелі, і розчин знебарвлюється). Захисну суміш приготовляють так: 70 г MnSO4 ^ 4 Н2О розчиняють у 500 мл води, доливають до розчину 125 мл концентрованої сірчаної кислоти і 125 мл 85%-ої фосфорної кислоти, після чого розчин розбавляють водою до 1 л. Роль сірчаної кислоти в суміші по-лягає в тому, що вона затримує утворення осаду фосфату олова при добавлянні суміші до розчину солей заліза (II), що містить іони олова (IV).
|
|
|
Розчин хлориду олова (II) приготовляють так: 100—150 г SnCl2 • 2Н2О розчиняють при нагріванні в 1 л розведеної (1: 2) соляної кислоти. Розчин зберігають у закритій склянці, на дно якої, щоб запобігти окисленню SnCl2 киснем повітря, вміщують кусочки металічного олова. Відновлення FeCl3 і титрування перманганатом повторюють ще 1—2 рази, відбираючи піпеткою з мірної колби нові порції розчину. Розходження між результатами паралельних визначень не повинні перевищувати 0,2—0,3 мл 0,1 н. розчину KMnO4. Процентний вміст заліза в руді обчислюють за рівнянням
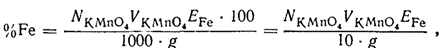
де N і V — відповідно нормальність і об'єм розчину перманганату, витраченого на титрування; Е — еквівалент заліза, що чисельно дорівнює його атомній масі; g — наважка руди, г.
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 567; Нарушение авторских прав?; Мы поможем в написании вашей работы!