
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кислотно-основное титрование
|
|
|
|
В основе этого вида титрования лежит реакция нейтрализации: Н+ + ОН- → НОН. В КОТ выделяют два метода:
1) ацидиметрия – используется для определения оснований, в качестве титрантов – растворы сильных кислот (Н2SO4, HCl);
2) алкалиметрия – используются для определения кислот, титрантами выступают щелочи (NaOH).
Процесс титрования методом нейтрализации зависит от природы исследуемого вещества и титранта. Здесь возможны три варианта:
1) сильная кислота + сильное основание:
NaOH + HCl = NaCl + H2O; Н+ + ОН- → НОН. Хлорид натрия – соль, образованная сильной кислотой и сильным основанием, поэтому гидролизу не подвергается, следовательно, в ТЭ раствор будет иметь нейтральную среду (рН=7).
2) слабая кислота + сильное основание:
НСООН + NaOH = HCOONa + H2O.
Формиат натрия гидролизуется: HCOONa + HOH ↔ HCOOH + NaOH,
HCOO- + HOH ↔ HCOOH + OH- - среда щелочная (рН>7), т.е. ТЭ не совпадает с точкой нейтральности и будет находиться в щелочной среде.
3) сильная кислота + слабое основание:
NH4OH + HCl = NH4Cl + HOH.
Хлорид аммония гидролизуется: NH4Сl + НОН ↔ NH4OH + HCl,
NH4+ + НОН ↔ NH4OH + H+ - среда кислая (pH<7), т.е. ТЭ будет находиться в кислой среде.
Вывод: природа реагирующих веществ непосредственно влияет на величину рН раствора в ТЭ.
Р. нейтрализации обычно протекают без видимых изменений свойств раствора, поэтому в титриметрии используют специальные вещества, способные обратимо изменять свою окраску в растворе в зависимости от рН среды – индикаторы. Выбор индикатора для анализа зависит от природы реагирующих веществ и природы самого индикатора. Экспериментально установлено, что окраска индикатора изменяется в определённом интервале рН (интервал перехода):
| Индикатор | Интервал перехода (рН) | Окраска в средах | ||
| НОН | Н+ | ОН- | ||
| лакмус | 5-8 | фиолетовый | красный | синий |
| фенолфталеин | 8-10 | бесцветный | бесцветный | малиновый |
| метилоранж | 3-4,4 | оранжевый | красный | желтый |
Существую несколько теорий, объясняющих механизм изменения окраски индикаторов:
1) Ионная теория (Оствальд, 1894) – рассматривает индикаторы как органические кислоты и основания, диссоциирующие в растворе на ионы. При этом молекулярная и ионная формы индикатора имеют разную окраску:
HInd (red) ↔ H+ + Ind- (blue) (в нейтр. среде – равновесие форм, окраска фиол.(лакмус))
В кислой среде: H+ + Ind- → HInd – красный
В щелочной среде: HInd + ОН- → Ind- + Н2О (синий)
Недостаток теории – не учитывает влияния строения молекул индикаторов на цветность
2) Хромоформная теория - изменение окраски индикаторов связано с обратимой пере-
группировкой атомов в молекуле органического соединения. Такая обратимая перегруппировка в органической химии называется таутомерией. Она происходит при изменении рН раствора. Установлено, что в молекулах индикатора имеются группировки атомов с кратными связями (-N=N-, O=N-, =C=O). Такие группировки называются хромофорами, они способны избирательно поглощать электромагнитные колебания УФ спектра и, следовательно, изменять окраску. Когда таутомерное превращение ведет к изменению строения хромофора – окраска изменяется; если же после перегруппировки молекула не содержит более хромофора – окраска исчезнет.
Недостаток – не учитывает диссоциацию молекул индикатора в растворе.
3) Согласно ионно-хромофорной теории, изменение окраски индикаторов обусловлено переходом из ионной формы в молекулярную, и наоборот, сопровождающегося изменением структуры индикаторов. Таким образом, один и тот же индикатор может существовать в двух формах с разным строением молекул, причем эти формы могут переходить одна в другую, и в растворе между ними устанавливается равновесие.
Пример: фенолфталеин:
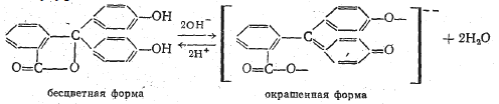
Смещение равновесия между таутомерными формами происходит постепенно (интервал перехода), поэтому и окраска раствора меняется постепенно через смешанную окраску.
Наряду с интервалом перехода окраски индикатора пользуются также показателем титрования индикатора (рТ). рТ – это оптимальное значение рН титруемого раствора, при котором наблюдается наиболее резкое изменение окраски индикатора, свидетельствующее об окончании титрования (метилоранж = 4, лакмус = 7, ф/ф = 9).
Для графического отображения и количественной оценки процесса титрования, а также для правильного выбора индикатора используют кривые титрования. Для этого проводят опытное титрование 20мл 0.1н. раствора НСl 0.1н. раствором NaOH. Строят зависимость изменения рН раствора от объема добавленной щелочи. (ось Х – объем щелочи, ось У – рН раствора). Т.к. рН=-lg [H+], то кривую называют логарифмической кривой титрования.
Уравнение реакции: NaOH + HCl → NaCl +HOH, соль образована сильным основанием и сильной кислотой, в растворе диссоциирует полностью и не гидролизуется.
Соляная кислота – сильная кислота, степень ее диссоциации = 1, т.е. [H+]=[HCl]
1 точка начальная (исходная): 0.1н р-р HCl => 0.1 моль (α=1, т.к. сильная кислота) => [H+]=[HCl]= 0.1 моль/л=10-1 => pH=1
2 точка: к 20 мл 0.1н р-ра НСl добавляют 18 мл 0.1н р-ра NaOH => в р-ре осталось 2 мл HCl, т.е. в 10 раз меньше => [HCl]= [H+]=0.01 моль/л=10-2 => pH=2
3 точка добавляют 19.8 мл 0.1н р-ра NaOH => в р-ре осталось 0.2 мл HCl, т.е. в 100 раз меньше начального количества => [HCl]= [H+]=0.001 моль/л=10-3 => pH=3
4 точка добавляют 19.98 мл 0.1н р-ра NaOH => в р-ре осталось 0.02 мл HCl, т.е. в 1000 раз меньше начального количества => [HCl]= [H+]=0.0001 моль/л=10-4 => pH=4
5 точка добавляют 20 мл 0.1н р-ра NaOH => вс HCl польностью нейтрализована, т.е. в 100 раз меньше начального количества => [ОH-]= [H+]=10-7 моль/л => pH=7
6 точка добавляют 20.02 мл 0.1н р-ра NaOH => в р-ре избыток 0.02 мл HCl, это в 1000 раз меньше, чем в 20 мл 0.1н р-ра NaOH => [NaOH ]= [ОН-]=0.0001 моль/л=10-4 => pОH=4 => рН=14-4=10
7 точка добавляют 20.2 мл 0.1н р-ра NaOH => в р-ре избыток 0.2 мл HCl, это в 100 раз меньше, чем в 20 мл 0.1н р-ра NaOH => [NaOH ]= [ОН-]=0.001 моль/л=10-3 => pОH=3 => рН=14-3=11
8 точка добавляют 22 мл 0.1н р-ра NaOH => в р-ре избыток 2 мл HCl, т.е. в 10 раз меньше, чем в 20 мл 0.1н р-ра NaOH => [NaOH ]= [ОН-]=0.01 моль/л=10-2 => pОH=2 => рН=14-2=12
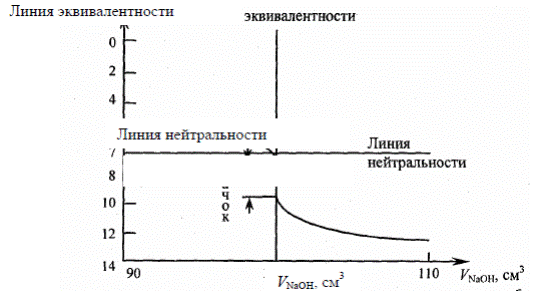
На кривой титрования видно, что 99,9% щелочи рН раствора изменяется постепенно, затем при добавлении очень малого количества щелочи происходит резкое увеличение рН раствора – скачок титрования.
Выводы по кривой титрования:
1) точка эквивалентности лежит на линии нейтральности
2) скачок титрования имеет большой интервал от рН=4 до рН=10
3) для определения ТЭ надо использовать индикаторы, интервал перехода которых лежит в пределах скачка титрования (фенолфталеин).
| ВЫБОР ИНДИКАТОРА 1 Интервал перехода индикатора должен совпадать со скачком титрования или хотя бы частично касаться точки эквивалентности. 2 Индикатора надо добавлять мало, так как он взаимодействует с определяемым веществом или титрантом. 3 Практически всегда имеет место ошибка, связанная с несовпадением точки эквивалентности с конечной точкой титрования. 4 Индикаторная ошибка титрования должна быть незначительной. |
Ошибки кислотно-основного титрования:
1 Субъективные ошибки обусловлены несовершенством измерительных приборов и глаза, неточностью взвешивания.
2 Индикаторные ошибки. Обусловлено тем, что изменение окраски индикатора происходит не мгновенно, а в определенном интервале рН и не всегда в ТЭ
3 Гидроксильная ошибка обусловлена недотитрованием сильного основания сильной кислотой (отрицательная ошибка) или перетированием сильной кислоты сильным основанием (положительная ошибка). (Всегда необходимо ставить холостой опыт)
|
|
|
|
|
Дата добавления: 2014-01-14; Просмотров: 2333; Нарушение авторских прав?; Мы поможем в написании вашей работы!