
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Металлы и сплавы
|
|
|
|
Строение. По своему строению все твердые вещества делятся на аморфные и кристаллические. Аморфными называют твердые вещества, атомы которых расположены в пространстве беспорядочно (стекло, многие пластмассы, смолы и др.). Кристаллическими называют твердые вещества, атомы (ионы) которых расположены в пространстве в строгом, периодически повторяющемся порядки и образуют кристаллическую решетку (металлы, соли и др.).
Кристаллическая решетка состоит из большого количества одинаковых элементарных ячеек, образованных атомами металла. Однако кристаллическая решетка реальных металлов имеет ряд нарушений. Это, например (рис. 1),

Рис. 1. Схема кристаллической решетки:
1- вакансия, 2- дислокация
вакансии 1 - незанятые атомами узлы кристаллической решетки, дислокации 2 - нарушения в расположении целого ряда атомов.
Характеристиками кристаллической решетки являются: период решетки - расстояние а и с (рис. 2) между центрами двух соседних атомов по ребру элементарной ячейки. Периоды решетки измеряют в ангстремах (1А=10-8 см) и килоиксах (1КХ= 1,00202 ×10-8 см); координационное число К - количество атомов, находящихся на наиболее близком и равном расстоянии от любого выбранного атома в решетке; атомный радиус - половина расстояния между центрами ближайших атомов и кристаллической решетке без искажений; базис решетки - количество атомов в одной элементарной ячейке решетки; коэффициент компактности η решетки - отношение объема, занимаемого атомами, ко всему объему решетки.
Существует большое количество кристаллических решеток различной сложности. Большинство металлов имеет простейшие типы кристаллических решеток: кубическую объемно-центрированную (ОЦК) - рис. 2, а, кубическую гранецентрированную (ГЦК) - рис. 2,б, гексагональную плотноупакованную (ГПУ) рис. 2, в.
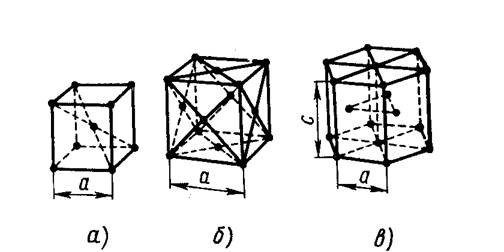
Рис.2. Типы кристаллических решеток металлов.
Кубическую объемно-центрированную решетку имеют Fе (при температуре ниже 910°С), Сг, Мо, Nb, Ва, V, Nа и др. ОЦК решетка имеет период а, координационное число К=8, базис решетки равен 2, коэффициент компактности η = 68%.
Кубическую гранецентрированную решетку имеют Fе (при температуре выше 910°С), А1, Ni, Сu, Аu, Рb, Аg, Рtи др. ГЦК решетка имеет период а, координационное число К =12, базис решетки равен 4, коэффициент компактности η = 74%.
Гексагональную плотноупакованную решетку имеют Мg, Zn, Ве, Os, Rе и другие металлы. ГПУ решетка имеет периоды а и с (с/а = 1,633), координационное число К =12, базис решетки равен 6, коэффициент компактности η=74%.
Упрощенно можно считать, что атомы металлов состоят из положительно заряженных ядер и отрицательно заряженных частиц - электронов. Электроны движутся вокруг ядра на различных расстояниях, образуя электронную оболочку. Наружные (валентные) электроны атомов металла, находящегося в жидком и твердом состояниях, слабо притягиваются ядром и могут свободно «переходить» от одного атома к другому, как бы образуя «электронный газ».
Атомно-кристаллическим строением объясняются физико-химические и механические свойства металлов (высокая электро- и теплопроводность, металлический блеск, пластичность и др.).
Все металлы представляют собой поликристаллические вещества, т. е. состоят из множества мелких (10-1 – 10-3 см) кристалликов неправильной формы. Эти кристаллики называются кристаллитами или зернами. Зерна металла имеют различную ориентацию в пространстве. Зерна (рис. 3, а) состоят из совсем маленьких мало разориентированных участков – блоков- 10-5 – 10-3 см. (рис. 3,б).
Рис.3. Схема ориентации зерен (а) и блоков (б) в металле.
Чистые металлы (содержат 9,99-99,999% основного металла) применяют в промышленности в ограниченном количестве и только для специальных целей. Наиболее широкое применение находят различные сплавы.
Сплавы получают различными способами. Чаще всего сплавы получают сплавлением двух или нескольких металлов или металлов с неметаллами. Химические элементы, образующие сплав, называются компонентами. Сплав состоит из одной или нескольких фаз. Фаза - это часть сплава, имеющая одинаковые состав и агрегатное состояние и отделенная от остальных частей поверхностью раздела. Чистый твердый металл является однофазной системой, а затвердевающий металл двухфазной системой: кристаллы - твердая фаза, а расплав - жидкая фаза.
Кристаллизация. Процесс перехода чистого металла из жидкого состояния в твердое называется кристаллизацией. Процесс кристаллизации схематически можно представить следующим образом (рис. 4). Нагретый жидкий металл постепенно охлаждается от температуры Т до температуры плавления Тпл При этой температуре Тпл начинается процесс кристаллизации металла, который продолжается определенное время от t1 до t2. В этот период температура металла не понижается, так как процесс идет с выделением теплоты. Процесс кристаллизации начинается с образования мельчайших твердых частиц - зародышей. Зародыши являются центрами кристаллизации. Из них растут твердые кристаллы. До определенного момента количество центров кристаллизации увеличивается, и сами кристаллы растут до соприкосновения друг с другом, при этом количество жидкого металла все время уменьшается. Когда весь жидкий металл превращается в твердый - процесс кристаллизации закончен, дальше происходит охлаждение уже твердого металла.

Рис.4. Схема кристаллизации металлов.
Строение сплава зависит от характера взаимодействия компонентов, которые его образуют. Если компоненты образуют раствор не только в жидком состоянии, но и в твердом - это твердый раствор. Он однофазный (рис. 5, а), имеет одну кристаллическую решетку. Если атомы одного компонента частично замещают атомы другого компонента в кристаллической решетке (рис. 5, б), то это твердый раствор замещения. Если же атомы одного компонента располагаются между атомами другого компонента в кристаллической решетке (рис. 5, в), то это твердый раствор внедрен и я.
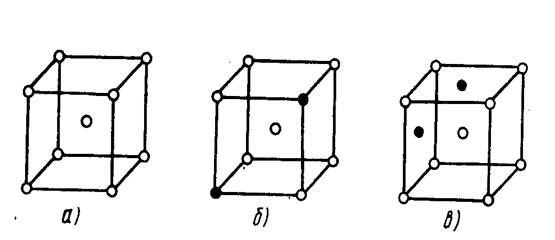
Рис.6. Кристаллическая решетка металла:
а- чистый металл, б- твердый раствор замещения, в- твердый раствор внедрения
Компоненты сплава в результате химического взаимодействия могут образовать химическое соединение.
Компоненты могут не образовывать твердого раствора и не вступать в химическое соединение. В этом случае сплав представляет собой механическую смесь компонентов.
Черные и цветные металлы. Металлы условно делятся на две большие группы: черные и цветные.
К черным металлам относятся Fе, Со, N1, Мn, тугоплавкие металлы Nb, Тi, W и др. (их температура плавления выше 1539°С), урановые металлы (актиноиды) Тh, U, Pu и другие, редкоземельные металлы (лантаноиды) Се, La и др. К цветным металлам относятся легкие металлы (Ве, Мg, А1), благородные металлы (Аg, Аu, Рt), Сu, легкоплавкие металлы (Zn, Сd, Sn. Рb) и др.
|
|
|
|
Дата добавления: 2014-01-14; Просмотров: 1021; Нарушение авторских прав?; Мы поможем в написании вашей работы!