
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
При обратном процессе, при переходе пара в воду или воды в лед, эти теплоты выделяется
|
|
|
|
Испарение и кипение
Фазовые превращения вещества служат ярким примером проявления закона перехода количественных изменений в качественные.
Фазовые переходы первого рода — это процессы плавления, кристаллизации, испарения, конденсации и т. д. Процессы фазовых переходов первого рода характеризуются тем, что при их осуществлении поглощается или выделяется теплота.
Если взять твердое тело, например лед, то для того чтобы лед превратить в воду, необходимо затратить при нормальном давлении 335 дж на каждый грамм льда. Чтобы испарить один грамм воды при температуре кипения 100° С при нормальном давлении 760 мм рт. ст., требуется затратить 2260 дж. Это теплоты плавления и испарения.
Qис=rm
Qпл=Lm
Рассмотрим процесс перехода из жидкой фазы в газообразную — процесс испарения, в частности процесс кипения. Процесс испарения заключается в том, что молекулы-жидкости, обладающие наибольшей кинетической энергией, выходят через поверхность жидкости наружу, преодолев силы молекулярного притяжения. Чтобы такие молекулы могли проникнуть через поверхностный слой, кинетическая энергия молекулы w0 = 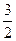 kT должна быть больше чем работа, которая совершается против сил молекулярного притяжения. Силу молекулярного притяжения приходится преодолевать не только в пределах поверхностного слоя толщиной г, но и на некотором расстоянии от поверхности жидкости, потому что когда молекула уже вышла за поверхностный слой, то на нее продолжают действовать молекулы жидкости, они продолжают притягивать ее, пока молекула не отдалится на такое расстояние, на котором силы притяжения достаточно ослабевают. Можно показать, что действие этих сил сказывается на расстоянии, равном радиусу сферы действия молекулярных сил, и можно считать, что молекула должна преодолевать поверхностный слой удвоенной толщины 2г. Поэтому кинетическая энергия должна быть больше, чем 2rf, где r — радиус сферы молекулярных сил, a f — средняя величина силы притяжения, действующего на молекулу. Молекулярное давление, очень большая величина. Для воды оно порядка 11 000 атм. Следовательно, молекула должна обладать весьма большой кинетической энергией для того, чтобы она могла выйти на поверхность. В первую очередь на поверхность могут выйти те молекулы, которые обладают наибольшей энергией, наиболее «нагретые» молекулы. В результате этого средняя энергия оставшихся молекул уменьшается и процесс испарения будет сопровождаться охлаждением, это охлаждение определяет теплоту испарения.
kT должна быть больше чем работа, которая совершается против сил молекулярного притяжения. Силу молекулярного притяжения приходится преодолевать не только в пределах поверхностного слоя толщиной г, но и на некотором расстоянии от поверхности жидкости, потому что когда молекула уже вышла за поверхностный слой, то на нее продолжают действовать молекулы жидкости, они продолжают притягивать ее, пока молекула не отдалится на такое расстояние, на котором силы притяжения достаточно ослабевают. Можно показать, что действие этих сил сказывается на расстоянии, равном радиусу сферы действия молекулярных сил, и можно считать, что молекула должна преодолевать поверхностный слой удвоенной толщины 2г. Поэтому кинетическая энергия должна быть больше, чем 2rf, где r — радиус сферы молекулярных сил, a f — средняя величина силы притяжения, действующего на молекулу. Молекулярное давление, очень большая величина. Для воды оно порядка 11 000 атм. Следовательно, молекула должна обладать весьма большой кинетической энергией для того, чтобы она могла выйти на поверхность. В первую очередь на поверхность могут выйти те молекулы, которые обладают наибольшей энергией, наиболее «нагретые» молекулы. В результате этого средняя энергия оставшихся молекул уменьшается и процесс испарения будет сопровождаться охлаждением, это охлаждение определяет теплоту испарения.
Одновременно происходит и противоположный процесс. Некоторые молекулы пара из воздуха проникают обратно в жидкость, происходит процесс конденсации. Оба противоположно идущих процесса — процесс испарения и процесс конденсации — происходят непрерывно. Если испарение более интенсивно, чем конденсация, то жидкость испаряется. Если конденсация идет более интенсивно, то количество жидкости увеличивается. Может преобладать или первый, или второй процесс, но может быть и равновесие. Равновесие может быть только при вполне определенной для данной температуры плотности пара. Такая плотность называется равновесной плотностью, состояние равновесия является динамическим равновесием. При таком равновесии за единицу времени испаряется столько же молекул, сколько их конденсируется. Пар в состоянии равновесной плотности называется насыщенным паром. Равновесная плотность паров данной жидкости, а следовательно, и их давление зависят только от температуры: с возрастанием температуры давление насыщающих паров быстро возрастает.
Построим изотермы насыщающего пара. Его изотермы при температурах T1, T2, Тз,..., Tk (если мы строим обычную рV-диаграмму) представляют собой прямые (рис. 1). Эти изотермы не что иное, как горизонтальные участки кривых Ван-дер-Ваальса. Давление для насыщающих паров остается постоянным. Система является двухфазной.
 Вернемся к процессу испарения. При адиабатном испарении температура понижается. Если же испарение происходит не адиабатно, а изотермически, т. е. если мы подводим теплоту в течение процесса испарения, то количество подведенной теплоты при постоянной температуре испарения всегда окажется для данной жидкости одним и тем же. При изменении температуры испарения это количество теплоты также изменяется.
Вернемся к процессу испарения. При адиабатном испарении температура понижается. Если же испарение происходит не адиабатно, а изотермически, т. е. если мы подводим теплоту в течение процесса испарения, то количество подведенной теплоты при постоянной температуре испарения всегда окажется для данной жидкости одним и тем же. При изменении температуры испарения это количество теплоты также изменяется.
При кипении под постоянным давлением температура жидкости остается неизменной. При нагревании жидкости до начала кипения большая часть теплоты, подводимой от нагревателя, расходуется на нагревание, меньшая часть теплоты расходуется на испарение. Для того чтобы началось кипение, жидкость должна содержать пузырьки воздуха или другого газа, система должна быть двухфазной, иначе кипение не может начаться. Действительно, если в жидкости отсутствуют пузырьки газа, то для вскипания, состоящего в образовании и всплывании множества пузырьков, необходимо, чтобы довольно значительное количество наиболее быстрых молекул, сблизившись между собой, образовали хотя бы микроскопический пузырек, который затем послужит в качестве зародыша для большого пузырька. Но, во-первых, такое сближение многих быстрых молекул очень маловероятно, а, во-вторых, микроскопический пузырек с очень малым радиусом будет испытывать огромное давление р =  кривой поверхности, которое его раздавит: кипение не начнется.
кривой поверхности, которое его раздавит: кипение не начнется.
Если же в жидкости имеются небольшие пузырьки воздуха, прилипшие к стенкам сосуда или к другим предметам, находящимся внутри жидкости, то эти пузырьки служат центрами парообразования. Жидкость испаряется внутрь пузырьков, которые растут, затем отрываются и всплывают. Отрывается пузырек не полностью, от него остается небольшой зародышевый пузырек, который опять раздувается, отрывается и т. д.
Присмотревшись к кипящей в стеклянном сосуде воде, легко заметить, что действительно все всплывающие пузырьки идут цепочками из определенных точек на стенках, где находятся зародышевые пузырьки. Во время кипения вся подводимая к жидкости теплота идет на испарение, поэтому температура кипящей жидкости остается постоянной. Причина этого заключается в том, что при самом незначительном повышении температуры испарение жидкости в пузырьке резко увеличивается, образование и отрыв пузырьков происходит чаще и снова устанавливается равновесие между притоком теплоты от нагревателя и расходом теплоты на испарение, так как ускорившийся процесс испарения вызывает понижение температуры до величины, определяемой суммой атмосферного и гидростатического давлений в жидкости в месте нахождения пузырька.
Зародышевый пузырек обязательно должен состоять из воздуха или другого газа, но не из пара самой жидкости, ибо только в первом случае он может находиться в равновесном состоянии. При увеличении внешнего давления пузырек сжимается, давление газа в нем растет. Если бы пузырек состоял только из пара, то при увеличении давления выше равновесного пар переходил бы в жидкость и объем пузырька уменьшался бы до нуля.
Условие равновесия для пузырька, находящегося в жидкости, можно записать так:
 (3. 8)
(3. 8)
Здесь р = f(Т) - давление насыщающих паров внутри пузырька,
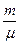
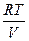 - давление воздуха внутри пузырька, Р — атмосферное давление, r gh — гидростатическое давление в жидкости на уровне местонахождения пузырька,
- давление воздуха внутри пузырька, Р — атмосферное давление, r gh — гидростатическое давление в жидкости на уровне местонахождения пузырька, 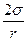 - Лапласово давление кривой поверхности пузырька.
- Лапласово давление кривой поверхности пузырька.
Пузырек удерживается на стенке, к которой он прилип, с некоторой силой F. До момента отрыва и всплытия пузырька эта сила должна быть больше архимедовой силы:
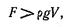 (3. 9)
(3. 9)
где r - плотность жидкости, а V — объем пузырька.
|
|
|
|
Дата добавления: 2014-01-14; Просмотров: 1236; Нарушение авторских прав?; Мы поможем в написании вашей работы!