
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Модель атома Бора
|
|
|
|
Классическая физика была основана на ряде блестящих экспериментов, среди которых особое место занимают опыты Г. Кавендиша, Ш. Кулона и М. Фарадея. Ими были установлены законы гравитационного и электромагнитного взаимодействия макроскопических тел. Однако технология эксперимента, которая использовалась Кавендишем, Кулоном и Фарадеем, в микрофизике неприменима из-за малых размеров исследуемых объектов.
Из опытов по рассеянию был сделан вывод, что электроны распределены в атоме относительно равномерно. При этом долго оставалось неясным, где расположен положительный заряд, компенсирующий заряд электронов. Дж. Дж. Томсон, например, постулировал, что положительный заряд также равномерно размазан по объему атома (томсоновская модель атома). Но протон - электронная модель ядра сразу же столкнулась со значительным противоречием. Она не смогла объяснить спин ядра, отличного от водорода.
Ясность в вопрос о распределении положительного заряда внесли эксперименты Резерфорда. Схема этих опытов показана на рис. 1.1. Эксперимент заключался в рассеянии a -частиц из радиоактивного источника на веществе мишени.

Рис. 1.1. Схема опыта Резерфорда. 1- мишень; 2- a- частицы; 3- источник;
4- рассеянные частицы; 5- флюоресцирующий экран; 6- неотклонившиеся или слабо отклонившиеся частицы.
Рассеянные a-частицы наблюдались визуально в виде вспышек на флюоресцирующем экране. Из эксперимента следовало, что положительный заряд атома сосредоточен в малой центральной области атома, ядре, размерами»10-12 см (для сравнения размеры атома »10-8 см). Только так можно было объяснить наличие небольшого числа a-частиц (около 10-4 от общего числа), рассеянных на угол» 180°.
Действительно, этого нельзя объяснить в модели Томсона, в которой атом- слишком рыхлая система и силы, действующие на a-частицу слишком малы, чтобы резко изменить ее траекторию.
Найдем для обратного (на 180°) рассеяния расстояние наибольшего сближения rmin, отвечающее равенству кинетической энергии Ta кулоновского отталкивания Vc:
Ta= Vc=ZaZядe2/ rmin, отсюда rmin= ZaZядe2/ Ta=2·79·(4,8·10-10)2/(5·106 ·1,6·10-12)»4,6·10-12 см
Новая технология эксперимента, применимая для исследования микросистем, была предложена Э. Резерфордом и начинается с его опытов по рассеянию a -частиц. Именно, выяснив, что вероятность рассеяния a -частиц на атоме как функция угла рассеяния q подчиняется формуле для рассеяния заряженной частицы на кулоновском центре
 , (1.11)
, (1.11)
он выдвинул гипотезу, что в атоме имеется точечный кулоновский центр –атомное ядро, сосредотачивающий в себе почти всю массу атома. В формуле (1.11) Za , Zя – заряды (в единицах элементарного заряда) a -частицы и ядра мишени, Е – кинетическая энергия a-частицы.
Согласно теории, предложенной Эрнестом Резерфордом для объяснения рассеяния a - лучей, атом состоит из положительно заряженного ядра, окруженного роем электронов. В ядре сосредоточена основная масса атома, а линейные размеры ядра чрезвычайно малы по сравнению с расстояниями от ядра до окружающих его электронов. Число электронов в точности равно атомному номеру элемента.
Хотя ядерная теория атома, предложенная Резерфордом, оказалась очень полезной при объяснении многих важных свойств атома, тем не менее, она не смогла объяснить большое число других фундаментальных свойств и, прежде всего наличие стационарных электронных орбит в рамках классической электродинамики. Выход из создавшегося противоречия был найден Нильсом Бором. Последний, отталкиваясь от квантовой теории излучения, сформулированной Планком, предложил следующие постулаты, которые могли бы снять противоречия теории ядра Резерфорда:
А. Атомная система обладает стационарными состояниями, в которых не происходит излучения, связанного с потерей энергии, хотя согласно обычной электродинамике излучение должно иметь место.
В. Любое испускание или поглощение энергии соответствует переходу между двумя стационарными состояниями. Излучение такого перехода обладает частотой, определяемой соотношением
hn=Е1 – Е2,
где h – постоянная Планка; Е 1, Е 2 – значение энергии системы в двух стационарных состояниях.
Из положений Бора следовало, что момент импульса электронов может принимать квантованные значения
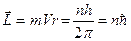 (1.12)
(1.12)
Тогда с учетом условия динамического равновесия (Fцентр=Fкулон) 

получается для полной энергии стационарного состояния E=T+U =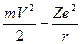 .
.
Принимая во внимание соотношение (1.12), получаем для полной энергии Е:
 ; или
; или 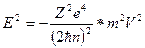 . Так как из условия динамического равновесия следует, что Е= - Т, то для полной энергии получаем выражение
. Так как из условия динамического равновесия следует, что Е= - Т, то для полной энергии получаем выражение
Е 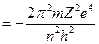 (1.13)
(1.13)
Откуда следует зависимость для частот спектра водородоподобных атомов, представляющая собой формулу Бальмера
n=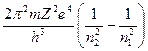 . (1.14)
. (1.14)
|
|
|
|
|
Дата добавления: 2014-01-14; Просмотров: 378; Нарушение авторских прав?; Мы поможем в написании вашей работы!