
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Физические свойства газа
|
|
|
|
Сіль містить комплексний аніон
Сіль містить комплексний катіон
Номенклатура комплексних сполук
Назви солей, що містять комплексний катіон,, і солей, що містять комплексний аніон, відрізняються по своїй структурі.
Першим називають аніон соли (сульфат, фосфат, хлорид і ін.). Потім називають вхідні у внутрішню сферу ліганди-аніони із закінченням на «о» (ОН- - гидроксо, С1- - хлоро, NO2 - нітро і т.д.) Після цього називають ліганди, що є нейтральними полярними молекулами (NН3 називають «аммін», Н2О - «аква») Якщо однакових лігандов у внутрішній сфері комплексу більше одного, то їх кількість указують грецькими числівниками (2 - ді, 3 - три, 4 - тетра,5 - пента,6 - гекса і т.д.)
Останніми називають центральні іон-комплексоутворювач, причому метали називають в українській транскрипції.
Якщо центральний атом має змінну валентність, то її указують римською цифрою в дужках після назви комплексоутворювача. Наприклад:
I
[Аg(NН3)2]С1 - хлорид діаммінсрібла (III)
II
[Сu(NН3)4]SО4 — сульфат тетрааммінміді (II)
III
[Со(NН3)4Cl2]С1 — хлорид дихлоротетрааммінкобальта (Ш).
Спочатку називають ліганди-аніони, потім молекулярні ліганди із закінченням «о», указуючи кількість їх грецькими числівниками. Потім називають комплексо-утворювач, використовуючи латинську назву елементу із додаванням суфікса «ат». Валентність центрального іона (якщо це необхідно) наголошується римськими цифрами в дужках після назви елементу. Останнім називають катіон, що знаходиться в зовнішній сфері (українська назва елементу в родовому відмінку). Число катіонів в назві солі не указується.
Наприклад:
К4[Fе(СN)6] - гексаціаноферрат (II) калія;
К3[Fе(СN)6] — гексаціаноферрат (III) калія;
К2[НgI4] — тетрайодомеркуріат (II) калія.
Состояние однородного газа определяется тремя параметрами — абсолютным давлением р, плотностью r и абсолютной температурой Т, из которых только два являются независимыми. Уравнение Ф (р, r, Т) = 0, связывающее эти величины, называется уравнением состояния.
Уравнение Клапейрона для массы газа т, занимающей объем V, имеет вид
pV= mRT, (1.10)
где R — газовая постоянная, измеряемая в СИ в Дж/ (кг • К). Уравнение (1.10) можно записать также в виде
p/r = RT. (1.11)
Уравнение Клапейрона для одного киломоля газа m записывается в виде
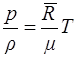 , (1.12)
, (1.12)
где 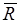 — универсальная газовая постоянная, величина постоянная для всех газов и равная 8314 Дж/ (кмоль • К).
— универсальная газовая постоянная, величина постоянная для всех газов и равная 8314 Дж/ (кмоль • К).
Для воздуха газовая постоянная равна
 . (1.13)
. (1.13)
Удельный объем газа u и его плотность r связаны соотношением:
 .
.
Газ называется совершенным, если давление р, плотность r и абсолютная температура Т удовлетворяют уравнению Клапейрона (1.11) или (1.12) и удельную внутреннюю энергию газа U можно представить в виде
 ,
,
где cV — теплоемкость газа при постоянном объеме.
Для реальных углеводородных газов уравнение состояния представляется следующим образом:
 (1.14)
(1.14)
или
 . (1.15)
. (1.15)
Здесь 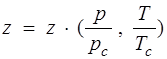 ; (1.16)
; (1.16)
z — коэффициент сжимаемости; рс, Тс — критические давление и температура, т.е. давление и температура в критической точке.
Критической точкой называется точка на карте изотерм (диаграмме состояния р — V — Т), в которой исчезает различие между насыщенным паром и жидкостью. При температуре выше критической не существует двухфазных состояний. Вещество находится в однофазном состоянии.
Для природных углеводородных газов коэффициент сжимаемости определяется по экспериментальным кривым.
Система находится в термодинамическом равновесии, если параметры, определяющие ее состояние, остаются постоянными.
Обратимым процессом называется процесс изменения состояния системы, который, будучи проведен в обратном направлении, возвращает ее в исходное состояние через те же промежуточные состояния и при этом в окружающей среде никаких изменений не происходит.
Обратимый процесс можно представить как непрерывную последовательность равновесных состояний, т.е. как квазистатический процесс. Только в том случае, когда реальный процесс может рассматриваться как квазистатический, при выводе формул, описывающих его, можно пользоваться уравнениями равновесного состояния (1.10) — (1.16).
Первое начало термодинамики выражает закон сохранения энергии в применении к преобразованиям механической энергии в тепловую и обратно. Для квазистатических процессов его можно сформулировать следующим образом: подведенное к единице массы газа элементарное количество теплоты dQ расходуется на повышение внутренней энергии газа dU ина выполнение работы расширения pdu:
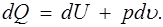 (1.17)
(1.17)
Количество теплоты dQ, сообщенное газу, не является полным дифференциалом, так как зависит не только от начального и конечного состояния газа, но и от самого процесса изменения состояния. Если уравнение (1.17) умножить на интегрирующий множитель 1/Т, то получим полный дифференциал некоторой функции, называемой энтропией:
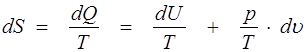 . (1.18)
. (1.18)
При переходе газа из состояния 1 в состояние 2 изменение энтропии S2 — S1 не зависит от процесса перехода, а определяется только начальным и конечным состояниями.
Для совершенного газа
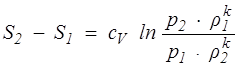 , (1.19)
, (1.19)
где k – сp / cV — показатель адиабаты Пуассона; ср и сV – теплоемкости газа при постоянном давлении и при постоянном объеме соответственно, отнесенные к единице массы. Они измеряются в СИ в Дж/(кг • К). Определенное по формуле (1.19) приращение энтропии тоже отнесено к единице массы.
Процесс, происходящий без теплообмена системы с окружающей средой, называется адиабатическим, а процесс, происходящий при постоянной энтропии, — изоэнтропическим. Изоэнтропический процесс описывается уравнением адиабаты Пуассона, которое получается из уравнения (1.19), если положить S2 = Sl, т.е.
 (1.20)
(1.20)
Процесс, происходящий при постоянной температуре, называется изотермическим. Он описывается уравнением Бойля — Мариотта:
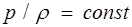 . (1.21)
. (1.21)
Энтальпией, отнесенной к единице массы (или теплосодержание при постоянном давлении), называется функция
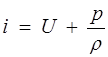 , (1.22)
, (1.22)
которая определяется только состоянием газа, например, его температурой и давлением.
При адиабатическом течении реального газа через дроссель (вентиль, диафрагму и т.д.) из области большего давления pi в область меньшего давления p2 наблюдается изменение температуры, вызванное изменением давления. Это явление называется эффектом Джоуля —Томсона. Если за дросселем восстанавливается начальная скорость течения газа, то энтальпия сохраняется неизменной:
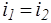 (1.23)
(1.23)
или
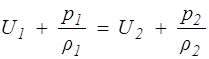 (1.24)
(1.24)
Температура в процессе Джоуля — Томсона может как повышаться, так и понижаться, в зависимости от характера сил взаимодействия между молекулами газа. Один и тот же газ при разных температурах может вести себя различно. Температура, при которой эффект меняет свой знак, называется точкой инверсии.
Дифференциальный эффект Джоуля — Томсона характеризуется коэффициентом Джоуля —Томсона
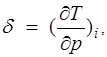 (1.25)
(1.25)
зависящим от температуры и давления.
При дросселировании от высокого давления р1 до значительно более низкого р2 температура газа меняется на конечную величину T1 — Т2. Этот процесс принято называть интегральным эффектом Джоуля — Томсона. Для его характеристики вводится среднее значение коэффициента Джоуля — Томсона:

 (1.26)
(1.26)
Для многих реальных газов составлены таблицы и построены графики зависимости энтальпии от температуры и давления, диаграмма i — Т для метана. Эти графики могут служить для расчета эффекта Джоуля — Томсона.
Для совершенного газа
 , (1.27)
, (1.27)
и изменение температуры за счет эффекта Джоуля — Томсона равно нулю.
|
|
|
|
Дата добавления: 2014-01-15; Просмотров: 417; Нарушение авторских прав?; Мы поможем в написании вашей работы!