
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электронное строение атомов в основном состоянии
|
|
|
|
Cходные по составу атомы
Сведения об элементарных частицах
| Частица | Заряд | Масса | ||
| Kл | Условные единицы | г | а.е.м. | |
| Электрон e | –1,6•10–19 | –1 | 9,1•10–28 | 0,00055 |
| Протон p | 1,6•10–19 | +1 | 1,67•10–24 | 1,007825 |
| Нейтрон n | 1,67•10–24 | 1,00866 |
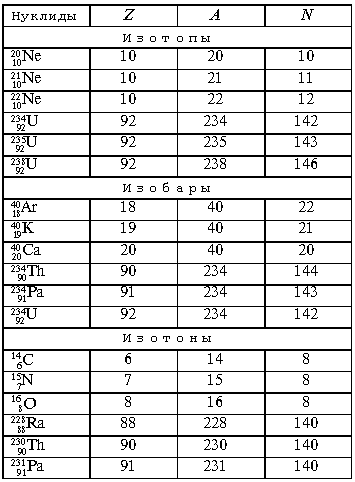
Примечание. A – массовое число, Z – заряд ядра атома, N – число нейтронов в ядре, A = Z + N.
Таблица
| Порядковый номер элемента | Элемент | Главное квантовое число | |||||||
| Электронный слой | |||||||||
| K | L | M | N | ||||||
| Энергетический подуровень | |||||||||
| 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | ||
| Число электронов на данном уровне | |||||||||
| 1 2 | Н He | 1 2 | |||||||
| 3 4 5 6 7 8 9 10 | Li Be B C N O F Ne | 2 2 2 2 2 2 2 2 | 1 2 2 2 2 2 2 2 | 0 0 1 2 3 4 5 6 | |||||
| 11 12 13 14 15 16 17 18 | Na Mg Al Si P S Cl Ar | 2 2 2 2 2 2 2 2 | 2 2 2 2 2 2 2 2 | 6 6 6 6 6 6 6 6 | 1 2 2 2 2 2 2 2 | 0 0 1 2 3 4 5 6 | |||
| 19 20 21 | K Ca Sc | 2 2 2 | 2 2 2 | 6 6 6 | 2 2 2 | 6 6 6 | 0 0 1 | 1 2 2 |
Данные о строении ядра и распределении электронов в атомах позволяют рассмотреть ПСХЭ Д.И.Менделеева с фундаментальных физических позиций. Однозначным признаком химического элемента является заряд ядра Z, определяемый числом протонов в ядре и равный порядковому номеру элемента в ПСХЭ. Относительная атомная масса – усредненное значение Ar изотопов природной смеси.
Общее число электронов в электронейтральных атомах равно числу протонов в ядре или порядковому номеру элемента.
Число энергетических уровней, на которых располагаются электроны в атоме, определяется номером периода. Чем больше номер периода у элемента, тем больше энергетических уровней в его атоме.
Число элементов в периодах можно определить по следующим формулам:
 для нечетных периодов
для нечетных периодов
Ln = (n + 1)2/2,
где Ln – число элементов в периоде, n – номер периода;
 для четных периодов
для четных периодов
Ln = (n + 2)2/2.
Задание 1. Определить число химических элементов в каждом периоде ПСХЭ.
Задание 2. Определить число главных и побочных подгрупп в ПСХЭ.
Решение
 Число главных подгрупп определяется максимальным числом электронов на s - и p -подуровнях.
Число главных подгрупп определяется максимальным числом электронов на s - и p -подуровнях.
 Число переходных элементов в 4-м периоде (от 21Sc до 30Zn), в 5-м (от 39Y до 48Cd) и
Число переходных элементов в 4-м периоде (от 21Sc до 30Zn), в 5-м (от 39Y до 48Cd) и
6-м (57La и от 72Hf до 80Hg) периодах равно 10 в каждом случае.
Число переходных элементов равно максимальному числу электронов на d -подуровне (10). Именно поэтому на 3-м (М) уровне на 10 электронов больше, чем на 2-м (L). Поскольку в каждом большом периоде периодической системы Д.И.Менделеева одна из побочных подгрупп содержит сразу три переходных элемента, близких по химическим свойствам:
4-й период – Fe–Co–Ni,
5-й период – Ru–Rh–Pd,
6-й период – Os–Ir–Pt,
то число побочных подгрупп....
(Проверить по периодической системе, сколько в ней главных и побочных подгрупп.)
Задание 3. Определить (по аналогии с переходными элементами) число лантаноидов и актиноидов, вынесенных в виде самостоятельных рядов вниз периодической системы.
Оно должно быть равно разности между максимальным числом электронов на … и … энергетических уровнях. Это число равно максимальному числу электронов на …-подуровне.
(Сверить вывод с периодической системой.)
Таким образом, строгая периодичность расположения элементов в ПСХЭ полностью
объясняется....
Периодическое изменение характера заполнения электронами внешних энергетических уровней вызывает периодические изменения химических свойств элементов и их соединений.
Электронные формулы элементов 2-го периода:
| 3Li – 1 s 22 s 1, 6С – 1 s 22 s 22 p 2, 9F – 1 s 22 s 22 p 5, | 4Be – 1 s 22 s 2, 7N – 1 s 22 s 22 p 3, 10Ne – 1 s 22 s 22 p 6, | 5B – 1 s 22 s 22 p 1, 8O – 1 s 22 s 22 p 4. |
При переходе от Li к Ne заряд ядра (Z) постепенно увеличивается от +3 до +10, что вызывает увеличение сил притяжения электронов к ядру. В результате радиусы атомов в этом ряду уменьшаются.
| Элемент | Li | Be | B | C | N | O | F |
| r (атома), в нм | 0,156 | 0,111 | 0,083 | 0,065 | 0,055 | 0,047 | 0,042 |
Поэтому способность отдавать электроны, ярко выраженная у лития, постепенно ослабевает при переходе к фтору, являющемуся типичным неметаллом. Элемент фтор в реакциях присоединяет электроны. Он имеет самую высокую электроотрицательность, равную 4. Начиная со следующего за неоном элемента натрия (Na, Z = 11), электронные структуры атомов повторяются. Как следствие, внешние электронные орбитали можно представить в общем виде, где n – номер периода:
| для Li и Na – ns 1, для B и Al – ns 2 np 1, для N и P – …….……., для F и Cl – …….……., | для Be и Mg – ns 2, для C и Si – …….……., для O и S – …….……., для Ne и Ar – …….…….. |
В 4-м периоде появляются переходные элементы, принадлежащие побочным подгруппам. Элементы одной и той же подгруппы имеют идентичный характер расположения электронов на внешних электронных уровнях, а принадлежащие к разным подгруппам одной и той же
группы – ….
Например, галогены (главная подгруппа VIIa) – ns 2 np 5 (идентичная конфигурация), элементы побочной подгруппы VIIб – (n – 1) s 2(n – 1) p 6(n – 1) d 5 ns 2 (cходная конфигурация). Сходство состоит в наличии у атомов обеих подгрупп семи валентных электронов, но их расположение по подуровням существенно отличается.
Задание 4. Указать и обосновать сходство и различие элементов главной и побочной подгрупп: а) V группы ПСХЭ; б) VI группы ПСХЭ; принадлежность этих элементов к s-, p-, d-, f-типам.
Задание 5. Привести конкретные примеры важнейших направлений развития химии на основе периодического закона и системы химических элементов Д.И.Менделеева.

|
|
|
|
|
Дата добавления: 2014-01-15; Просмотров: 1481; Нарушение авторских прав?; Мы поможем в написании вашей работы!