
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Цепной механизм и его стадии
|
|
|
|
Цепные реакции относятся к сложным реакциям и могут состоять из многих элементарных стадий. Любая цепная реакция обязательно включает три основные стадии: инициирование (зарождение цепи), продолжение и обрыв цепи. Инициирование - наиболее энергоемкая стадия цепных реакций, ее энергия активации определяется энергией разрываемой химической связи (обратная реакция - безактивационная). Поэтому образование активных частиц из молекул исходных веществ происходит лишь при достаточно высоких температурах или при воздействии света, ионизирующего излучения, ускоренных электронов и т. п.
В отсутствие энергетического воздействия образование активных частиц и инициирование цепных реакций может происходить при обычных температурах лишь в присутствии инициаторов - веществ, в молекулах которых энергия разрыва химической связи существенно меньше, чем в молекулах исходных веществ. Типичные инициаторы - органическое пероксиды и гидропероксиды, диазосоединения. Переносчики цепи образуются при последующих реакциях радикалов с молекулами реагентов, например:
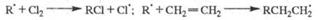
Инициаторы ускоряют образование активных частиц, т. е. являются катализаторами инициирования, но в отличие от катализаторов обычных (нецепных) процессов они расходуются (часто их называют расходуемыми катализаторами).
Продолжение цепи может быть проиллюстрировано на примере процессов фотохимический разложения Н2О2 в присутствии ионов Cu2+ и каталитических разложения Н2О2 при добавлении в раствор ионов Fe3+, которые имеют схожие цепные механизмы (переносчики цепи -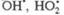 и Сu+ или Fe2+):
и Сu+ или Fe2+):

Представляют интерес цепные реакции в некоторых важнейших промышленных процессах. Так, для хлорирования органических соединений цепная реакция имеет вид:
|
|
|
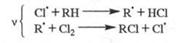
Многие атмосферные процессы относятся к цепным реакциям. Например, в процессах соокисления метана и NO, образования H2SO4 в облачных каплях, содержащих HSO4- (кислотные дожди), цепные реакции имеют вид:
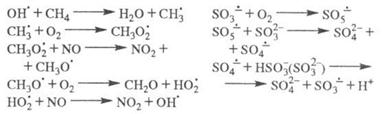
Стратосферные процессы разложения озона под действием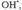

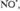
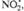

 также рассматриваются на основе представлений о ЦЕПНЫЕ РЕАКЦИИ р. и их стадиях; в частности
также рассматриваются на основе представлений о ЦЕПНЫЕ РЕАКЦИИ р. и их стадиях; в частности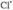 и
и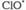 образуются из хладонов, их присутствие в стратосфере считается одним из основные факторов, ведущих к наблюдаемому уменьшению концентрации стратосферного озона.
образуются из хладонов, их присутствие в стратосфере считается одним из основные факторов, ведущих к наблюдаемому уменьшению концентрации стратосферного озона.
Обрыв цепи. Гибель переносчиков цепи при столкновениях со стенкой S реакционного сосуда происходит по механизму типа: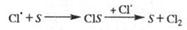
В этих случаях скорость реакции обрыва пропорциональна концентрации свободный радикалов - так называемой линейный обрыв. Чем больше отношение площади поверхности сосуда к его объему, тем интенсивнее гибель переносчиков цепи на стенке, тем короче цепь и меньше скорость реакции. Обрыв цепи вследствие столкновений радикалов - переносчиков цепи друг с другом и взаимного насыщения свободный валентности в объеме сосуда обычно происходит с участием третьей частицы М, роль которой состоит в отводе энергии от образующейся частицы:

Важнейший характерный признак цепных реакций - обрыв цепей на молекулах ингибитора - вещества, эффективно взаимодействующего с переносчиком цепи и дезактивирующего его в результате химический превращения. Ингибиторы цепного окисления - органическое вещество - так называемые антиоксиданты. Эффективными природными антиоксидантами являются аскорбиновая кислота и токоферол.
Все известные разветвленно-цепные реакции являются экзотермическими, причем часть выделяемой энергии переходит в энергию активных частиц. Поэтому для разветвления цепи необходимо, чтобы тепловой эффект брутто-процесса значительно превосходил тепловой эффект наиболее энергоемкой из всех стадий разветвления (для окисления Н2 это соответственно 483 и 70 кДж/моль). К изученным разветвленно-цепным реакциям относятся окисление паров Р, S; реакции О2 с CS2, CO, SiH4, углеводородами; разложение NCl3. Для всех этих реакций характерно наличие нижнего и верхнего пределов самовоспламенения.Создание новых технических электрохимических систем и технологий, обеспечивающих экологически безопасное настоящее и будущее для каждого человека и всего человечества возможно при грамотном отношении к новым материалам.
|
|
|
Среди новых видов покрытий все большее внимание исследователей привлекают электрохимические полимерные покрытия. К таким покрытиям относятся высокомолекулярные продукты (со)полимеризации или (со)поликонденсации, которые образуются в результате электрохимического инициирования или катализирования жидкого или растворенного мономера; причем окрашиваемое изделие является одним из электродов.
Электрохимические полимерные покрытия — одно из направлений современного развития лакокрасочной технологии — получения покрытий непосредственно из мономеров на подложке. В последнее время лакокрасочные покрытия из мономеров наносят под действием ионизирующего излучения или тлеющего разряда, путем адсорбции и полимеризации мономеров на слое порошкового полимера, в результате вторичной полимеризации мономеров, выделяющихся при термодеструкции фтор-полимеров и т. д. Методы формирования покрытий непосредственно из мономеров, в отличие от традиционных, позволяют исключить такие стадии технологического процесса, как синтез олигомеров или (со)полимеров в реакторе и их переработка в вязкотекучее состояние (расплав, дисперсию, раствор), нанесение полученных продуктов на поверхность подложки и превращение в кристаллическое или аморфное состояние при сушке.
При образовании электрохимических полимерных покрытий все вышеперечисленные стадии совмещаются в одной операции. Кроме того, происходит формирование покрытий на активированной электрохимическим процессом подложке, в частности, на поверхности цветных металлов и их сплавов. На современном этапе электрохимические полимерные покрытия легко получаются как на аноде, так и на катоде. Это особенно важно для формирования покрытий на анодно растворимых металлах. Основными преимуществами электрохимических полимерных покрытий являются: регулирование толщины слоя с помощью плотности тока или потенциала; получение особо тонких пленок, отличающихся своеобразным химическим составом и физико-техническими характеристиками; быстрота роста покрытий (в некоторых случаях процесс протекает за несколько секунд); автоматизация технологического процесса и проведение его при обычных условиях (комнатной температуре и нормальном давлении); невысокие энергетические затраты.
|
|
|
|
|
|
|
|
Дата добавления: 2014-01-15; Просмотров: 1076; Нарушение авторских прав?; Мы поможем в написании вашей работы!