
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Защитно-декоративные покрытия
|
|
|
|
Режим работы при железненнн на асимметричном переменном токе
Плотность тока 1к, А/дм2......... 20
Выход по току, %................ 80 — 90
Температура электролита, К..... 293
Детали восстановленные электролитическим железнением, представляют собой биметаллы, свойства которых существенно отличаются от свойств металлов (табл. 10.9). Это обстоятельство необходимо учитывать при выборе номенклатуры деталей, подлежащих восстановлению нанесением гальванических покрытий.
Назначение покрытия. Защитно-декоративные покрытия применяют в ремонтном производстве для защиты деталей от коррозии и придания им эстетического внешнего вида.
Наибольшей стойкостью обладают четырехслойные покрытия, которые получают последовательным нанесением слоев никеля, меди, никеля и хрома. Первый слой никеля толщиной не более 5 мкм обеспечивает высокую прочность сцепления покрытия с деталью. Слой меди толщиной до 30 мкм имеет небольшую пористость и обеспечивает хорошую защиту от проникновения коррозионной среды. Второй слой никеля (20 мкм) придает покрытию красивый внешний вид, а очень тонкий (1 — 2 мкм) полупрозрачный слой хрома защищает его от механических повреждении.
Электролитическое меднение. Медь—мягкий, пластичный, легко полирующийся металл. Плотность
ее —8,9 г/см3,температура плавления— 1356 К. В химических соединениях медь может быть одно и двухвалентной. Активно реагирует с азотной, серной и хромовой кислотами. Соляная кислота слабо действует на медь, особенно при нагревании. Щелочи, за исключением аммиака, почти не действуют. Нормальный потенциал меди + 0,34 В. Разность потенциалов меди и железа значительная, поэтому сталь с медным покрытием при его повреждении корродирует быстрее, чем сталь без покрытия. Как самостоятельное покрытие меднение применяется редко.
Электролитическое меднение в ремонтном производстве имеет следующие области применения: восстановление натяга в сопряженных деталях (меднение наружной поверхности вкладышей подшипников коленчатого вала); восстановление размеров деталей (меднение втулок по наружной поверхности с последующим их обжатием); улучшение плавности зацепления и облегчение приработки (меднение червяков, зубьев шестерен); защита поверхностей деталей и инструмента, не подлежащих цементации; получение промежуточного слоя при защитно-декоративных покрытиях стальных и цинковых деталей.
На ремонтных предприятиях широко применяют сернокислые холодные электролиты, состоящие из водного раствора медного купороса Си8О4- 5НгО (200 — 250 кг/м3) и серной кислоты Н25О4 (50 — 75 кг/м3). Покрытие наносят при помощи растворимых медных анодов при режиме: плотность тока — 2 — 4 А/дм2, температура электролита —291 — 293 К, выход по току равен 98—100 %.
Недостаток этих электролитов — невозможность непосредственно покрывать медью железо, цинк и их сплавы. При погружении последних в кислый электролит на их поверхности контактно выделяется медь, которая плохо сцеплена с основой и обладает большой пористостью. Поэтому при мед ненки стальных деталей предварительно наносят на них тонкий подслой никеля или медив пирофосфорном или цианистом электролитах.
Толщина медных покрытий зависит от их назначения. Так, толщина для придания притирочных свойств поверхностям деталей, а также для шестерней и других зубчатых соединений равна 18 — 24 мкм(до ЗО мкм), для защиты деталей от науглероживания при цементации —48—60 мкм, в качестве подслоя при никелировании и хромировании — 6 — 20 мкм.
Электролитическое никелирование. По физическим и химическим свойствам никель близок к железу. Никель химически стоек против атмосферного воздуха, щелочей и органических кислот. В серной и соляной кислотах он растворяется медленно, а в азотной — быстро. Никелевые покрытия хорошо полируются до зеркального блеска и приобретают красивый декоративный вид. При введении в электролит блескообразователей удается получить блестящие покрытия без полировки. Тонкие (до 25 мкм} никелевые покрытия обладают пористостью, которая уменьшается с увеличением толщины слоя.
По отношению к железу никель имеет менее электроотрицательный потенциал, т. е. является катодным покрытием. Поэтому стальные изделия защищают никелем от коррозии только тогда, когда в покрытии нет пористости и не покрытых никелем мест на поверхности детали. Толщина слоя никеля, при которой покрытие становится практически беспористым, — 25 — 30 мкм. Процесс никелирования осуществляется при комнатной температуре электролита, плотности тока — 1 А/дм2 и выходе потоку —90 —95%.
Состав электролита: сернокислый никель N1S04 — 140 кг/м3; сернокислый натрий Nа2SО4 — 50 кг/м3; борная кислота Н3ВО3 — 25 кг/м3; хлористый натрий NаС1 — 5 кг/м3; сернокислый магний МgSО4 — 10 кг/м3. Никелирование алюминия и его сплавов требует предварительной подготовки поверхности, включающей в себя травление и осветление в 15 — 20 %-ном растворе азотной кислоты для удаления примесей и легирующих добавок железа, марганца, меди и других металлов, не растворимых в щелочи. Затем проводят химическую обработку в растворе состава:
Сернокислый цинк (в пересчете
на металл), кг/м3...................................2 5 — 30
Едкий натр (каустик), кг/м3........... 120— 140
Режим обработки:
Температура, ° С............................. 15 — 20
Время, с......................................................... 30 — 40
Цинкатная обработка обеспечивает высокую прочность сцепления никеля с алюминием и его сплавами.
Существует электролит для прямого никелирования алюминия без какой-либо специальной подготовки. Травление выполняют в щелочи, а осветление — в азотной кислоте, затем загружают с выдержкой 1 — 2 мин без тока в электролит следующего состава, кг/м3:
Сернокислый никель............ 200
Борная кислота...................... 25
Фтористый натрий............ 2
Пиросульфат калия................ 2
Режим прямого никелирования:
Температура,° С.............................. 50
Кислотность, рН........................... 4,5 — 5,4
Катодная плотность тока, А/дм2.... 1 — 1,5
Выход металла по току................. 90 %
Никелевые покрытия можно получить также химическим путем. При химическом никелировании можно получить более равномерные осадки на деталях сложной конфигурации. Эти покрытия обладают повышенной твердостью и износостойкостью, имеют небольшую пористость и достаточно высокие декоративные свойства. Однако химическое никелирование дороже электролитического.
В основе процесса химического никелирования лежит реакция взаимодействия гипофосфита натрия с ионами никеля. В водном растворе гипофосфит натрия подвергается гидролизу с образованием фосфита натрия и атомарного водорода:

Атомарный водород, адсорбированный на поверхности покрываемого металла, восстанавливает ионы никеля:
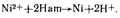
Одновременно атомарный водород взаимодействует с атомами Н2РО2- и Н2РО3-,восстанавливая фосфор, который включается в образуемое никелевое покрытие. При химическом никелировании всегда выделяется водород:
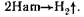
Химическое никелирование проводят в растворе следующего состава, кг/м3: хлорид никеля — 45; хлорид аммония — 50; гипофосфит натрия — 20 %, цитрат натрия — 45. Кислотность раствора — 5,5; температура — 78 — 82 ° С, производительность процесса — 15 — 20 мкм/ч.
После нанесения покрытия проводятся двукратная промывка деталей в проточной воде и их термическая обработка при температуре 40и°С с течение 1 ч. При этом образуется соединение Ni3Р, обладающее высокой твердостью; покрытие приобретает мелкозернистую структуру и повышенную сцепляемость с основным металлом.
Цинкование. Покрытие цинка применяют для защиты изделий из черных металлов (листов, труб, проволоки, деталей станков, автомобилей, тракторов, приборов, крепежных изделий) от коррозии. В ремонтном производстве их используют для защиты от коррозии крепежных деталей. Основные преимущества электролитического метода цинкования:
высокая степень чистоты цинка, зависящая главным образом от чистоты анодов и реактивов, применяемых для составления ванн;
высокая химическая стойкость цинковых покрытии, полученных электролизом, обусловленная чистотой осадка;
малый расход цинка, обусловленный возможностью точного регулирования количества цинка и толщины покрытия;
хорошие механические свойства покрытия (эластичность, сцепляемость с основой), достаточно высокая стойкость против коррозии в условиях тропического климата.
При цинковании наиболее распространены сернокислые электролиты следующего состава, кг/м3: сернокислый цинк — 200 — 250, сернокислый аммоний — 20 — 30, сернокислый натрий — 50 — 100 и декстрин — 8—12. Покрытие наносят в специальных вращающихся барабанах или колодках при комнатной температуре электролита и плотности тока 3 — 5 А/дм11. Выход по току составляет 92 %, толщина слоя — 3 — 40 мкм.
Оксидирование. Оксидирование черных металлов применяют для защиты их от коррозии, а также для придания поверхности красивой окраски. Для получения оксидной пленки на поверхности стали применяют химическую обработку изделий в щелочных или кислых растворах: электрохимическую обработку изделий на аноде, проводимую в щелочи или хромовой кислоте, термическую обработку при относительно высокой температуре. Наиболее распространено химическое оксидирование в горячих растворах едкого натра с добавкой окислителей. В процессе оксидирования сталь растворяется с образованием соли Nа2FеО2:
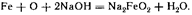
При большом содержании окислителя Ре2+ окисляется до Ре3+, и Nа2FеО2 переходит в Nа2Fе2О4. Эти две соли взаимодействуют между собой:

При этом на поверхности детали образуется оксидная пленка толщиной 0,6 — 1,5 мкм, которая имеет высокую прочность и надежно защищает металл от коррозии. Оксидированию подвергают нормали и некоторые детали арматуры кузова.
Оксидирование выполняют в растворе следующего состава, кг/м3: едкий натр — 700 — 800 с добавкой в качестве окислителей 200 — 250 азотнокислого натрия и 50 — 70 азотистокислого натрияпри температуре раствора 140 — 145 ° С с выдержкой 40 — 50 мин. После такой обработки детали промывают в воде и, для того чтобы закрыть поры в покрытии, пропитывают в машинном масле при температуре 110 — 115 " С.
Фосфатирование. Фосфатированием называется химический процесс создания на поверхности деталей защитных пленок толщиной от 8 до 40 мкм, состоящих из нерастворимых солей фосфора, марганца и железа. Защитная способность фосфатных пленок выше, чем оксидных, получаемых при щелочном оксидировании стали. Фосфатные покрытия применяют для защиты от коррозии, в качестве грунта при окраске деталей кузова, для уменьшения трения и улучшения прирабатываемости деталей.
Для получения фосфатных покрытий используют препарат Мажеф, который представляет собой смесь од-нозамещенных солей ортофосфорной кислоты, железа и марганца: Fe(Н2РО4)2Мn(Н2РО4)2* Н2О, МnНРО4 и имеет следующий химический состав, %: 2,4 —2,5 Ре; 14 Мn; 46—52 фосфатов (в пересчете на Р2О5), 1,0 SО42-, следы СаО, С1- и I — 2 воды.
Наиболее эффективно процесс фосфатирования протекает в растворе с концентрацией препарата Мажеф 30 — 33 кг/м3 при температуре 96 — 98 ° С. Продолжительность — 30 —50 мин.
Для повышения производительности и уменьшения температуры разработан процесс ускоренного фосфатирования с использованием ванны следующего химического состава,
кг/м3: препарат Мажеф — 30 — 40; Zn(М03)2-6Н2О — 50 — 65; NaF 2— 5. Температура — 45 — 65 ° С, продолжительность процесса — 8 — 15 мин.
|
|
|
|
Дата добавления: 2014-01-15; Просмотров: 801; Нарушение авторских прав?; Мы поможем в написании вашей работы!