
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Обратимые и необратимые процессы
|
|
|
|
Те процессы, в которых A=ΔG., называются обратимыми, так как, пустив такой процесс в обратном направлении и затратив работу A, можно полностью вернуть систему в исходное состояние. Таких процессов в природе не существует — все реальные процессы необратимы. Иными словами, свободная энергия системы не может быть полностью преобразована в работу. При таком преобразовании часть свободной энергии обязательно превращается в тепло. Характеризуя это явление, говорят о диссипации (рассеянии) свободной энергии. Чтобы достичь максимальной степени обратимости термодинамических процессов, нужно добиться минимальной разности (ΔG-A.), то есть уменьшить диссипацию свободной энергии. Конкретным способом уменьшения диссипации служит снижение электрического сопротивления в электрических цепях, трения — в механических системах и т. п.
В технике, и в биологии нас интересует в первую очередь работа, совершаемая системой. Поэтому важно знать не столько полную внутреннюю энергию системы, сколько ее свободную энергию. В большинстве случаев направление протекания процесса и его основные характеристики определяются именно свободной энергией.
Свободная энергия, как и полная, есть функция состояния, то есть функция тех условий, в которых находится система. Практически наиболее важными параметрами, определяющими состояние системы, являются температура, давление, число молей вещества, а при существовании внешнего поля (например, электромагнитного) — его напряженность. С учетом первых трех можно написать
G = f(T, p, v). (13)
Во многих системах, в частности в живых организмах, наиболее важным видом свободной энергии является химическая энергия молекул, входящих в систему. Для отображения этого обстоятельства введено понятие химического потенциала — μx:
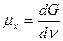 (14)
(14)
где v — число молей данного вещества. Следовательно, химический потенциал системы по отношению к некоторому веществу равен приросту свободной энергии системы при возрастании количества этого вещества на 1 моль:
ΔG = μx Δν (15)
В общем случае присутствия в системе к веществ:
ΔG =Σ μx Δν (16)
Учитывая существование химического потенциала и внешнего электрического поля, формулу (13) можно дополнить:
G = f(T, p, v, е), (17)
где vi — число молей i-ro вещества.
ПРИМЕНЕНИЕ ПЕРВОГО НАЧАЛА ТЕРМОДИНАМИКИ К ЖИВЫМ ОРГАНИЗМАМ
Применимость первого начала термодинамики к биологическим системам никогда не вызывала сомнений. Более того, как уже говорилось, оно сразу было сформулировано именно для живых организмов (Майер, Гельмгольц). Однако классическая форма этого закона, отображенная в формуле (2), была создана в связи с запросами теплотехники. Поэтому она не вполне удобна для биологии, так как не отображает сути термодинамических процессов, происходящих в живых системах. В отличие от тепловых машин, живые организмы производят работу не за счет тепловой энергии, а посредством использования химической энергии пищевых продуктов, усвоенных ими. Поэтому положение, согласно которому изменение внутренней энергии системы равно ее обмену энергией с окружающей средой, удобнее записать так:
ΔU=Wпищи-Q-A (18)
Перед Q в данном случае стоит знак «—», так как биологические системы отдают тепло окружающей среде.
Организм гомойотермных животных имеет постоянную температуру, и химический состав его в среднем не изменяется, поэтому и внутренняя энергия такого организма приблизительно постоянна. Следовательно, ΔU = 0. В этом случае
Wпищи = Q+ А (19)
Учитывая разные формы совершения работы и теплообмена, следует это выражение записать так:
Wпищи = ΣQ+ ΣА (20)
Последняя формула наиболее точно отображает существо первого начала термодинамики для биологических систем, особенно для гомойотермных животных.
Чтобы глубже проникнуть в особенности первого начала термодинамики для биологических систем, полезно сопоставить термодинамические процессы в тепловой машине и организме гомойотермных животных. Предварительно заметим, что первичным источником энергии в обоих случаях служит Солнце. Мощность солнечного излучения примерно 1026 Вт. Небольшая ее часть (2 1017 Вт) достигает поверхности Земли, а из этой величины только 0,02% поглощается зелеными растениями и запасается ими в процессе фотосинтеза. Поток энергии, извлекаемый зелеными растениями из солнечного света, имеет порядок 4 1013 Вт. За счет этой энергии работают тепловые машины и осуществляются все процессы жизнедеятельности. Однако способы преобразования в работу солнечной энергии, аккумулированной зелеными растениями в форме химической энергии, принципиально неодинаковы в тепловой машине и биологической системе. В тепловой машине топливо сжигают, преобразуя химическую энергию в тепловую, а затем уже последнюю превращают в работу. Заметим, что преобразование тепловой энергии в работу происходит при большом перепаде температур.
Принципиальным отличием термодинамических процессов в биологической системе является отсутствие промежуточного звена (в форме тепловой энергии) между химической энергией, запасенной в пище, и работой, совершаемой организмом. Энергия химических связей пищевых продуктов непосредственно преобразуется во все формы работы биологической системы. При этом образуется и тепловая энергия, но она представляет собой неизбежные энергетические потери. КПД для различных биологических процессов лежит в диапазоне от 20% до 60%. Различия термодинамических процессов в тепловой машине и биологической системе поясняет схема:
| тепловая машина | биологическая система |
| фотосинтез сжигание (02, Т) Wc →W топлива ------------- Q→ΔU + А; | фотосинтез биол окисление (O2) Wс →Wпищи ---------- -------------------- ΔU+A+Q. |
Напомним, что у гомойотермных животных ΔU = 0. Кроме того, учтем разные формы теплообмена и работы в организме, опустим левую часть схемы и тогда придем к выражению (20):
Wпищи = ΣQ+ ΣА
|
|
|
|
|
Дата добавления: 2014-01-15; Просмотров: 601; Нарушение авторских прав?; Мы поможем в написании вашей работы!