
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Будова атому з точки зору квантово-механічних уявлень
|
|
|
|
Квантово-механічний підхід до вивчення хімічних систем заснований на розв’язанні хвильового рівняння Шреденгера, що зводиться до визначення ймовірності знаходження електрону з енергією Е в певній точці простору в певний момент часу (електронної хмари, орбіта лі).
Орбіталь – та частина простору, де ймовірність знаходження електрону наближається приблизно до 95%. Існують s, p, d, f – атомні орбіталі, що відрізняються запасом енергії. Атомна орбіталь, що не зайнята електронами, називається вакантною.
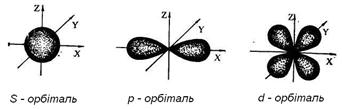
Розв’язання рівняння Щреденгера вимагає введення чотирьох квантових чисел для повної характеристики електрону:
п – головне квантове число, що характеризує відстань електрона від ядра та його енергія (від 1 до ∞). Кожному п відповідає енергетичний рівень.
l – орбітальне (азимутальне) квантове число, що визначає форму електронної орбіталі (від 0 до п-1).
т – магнітне квантове число, що показує розташування електронних орбіта лей у просторі (від –l до +l)орієнтацію кожної відносно іншої)
s – спінове квантове число, що характеризує обертання електрона довкола власної вісі (-1/2; +1/2).
Електронна конфігурація атому визначається наступними правилами:
• (правило Хунда) При заповненні орбіта лей з однаковою енергією на кожній із них розміщується по одному електрону з паралельними спінами, і тільки після цього починають заповнюватись електронами з протилежними спінами.
• (принцип Паулі) В атомі не може бути хоча б двох електронів з однаковими значеннями чотирьох квантових чисел.
• (правило Клечковського) Кожна нова орбіталь заповнюється лише після того, як будуть заповнені всі попередні орбіталі з нижчою енергією.
Типи хімічних зв’язків (самоопрацювання)
• Ковалентний
• Іонний
• Донорно-акцепторний
• Водневий
В органічних сполуках частіше реалізується ковалентний зв’язок
|
|
|
|
Дата добавления: 2014-01-11; Просмотров: 649; Нарушение авторских прав?; Мы поможем в написании вашей работы!