
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Буферні розчини. Механізм буферної дії. Розрахунок концентрації іонів водню та гідроксилу, а також рН і рОН у буферних розчинах. Використання у хімічному аналізі
|
|
|
|
ЯВИЩЕ АМФОТЕРНОСТІ
В деяких випадках при виконанні аналізу треба підтримувати на певному рівні величину рН розчину. Для цього використовують буферні розчини, які спроможні підтримувати постійне значення рН при додаванні до них невеликій кількості сильних кислот або луг, а також при розведенні. Буферна дія притаманна сумішам: слабої кислоти і її солі(кислотна буферна система); слабої основи і її солі(основна буферна система); кислих солей багато основних кислот. Механізм буферної дії засновано на тому, що замість сильних кислот і основ, які добавлені в буферний розчин, утворюються слабі кислоти чи основи і рН практично не змінюється. Розглянемо ацетатну буферну суміш:
CH3COOH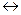 CH3COO- + H+,
CH3COO- + H+,
CH3COONa 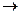 CH3COO- + Na+.
CH3COO- + Na+.
При додаванні сильної кислоти, вона взаємодіє з іонами CH3COO- з утворенням слабого електроліту CH3COOH:
CH3COO- + H+ 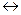 CH3COOH.
CH3COOH.
При додаванні сильної основи вона взаємодіє з кислотою з утворенням слабого електроліту – води:
CH3COOH + NaOH 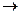 CH3COONa + H2O.
CH3COONa + H2O.
При розведенні водою буферна суміш зберігає постійне рН завдяки збільшенню ступеню іонізації при розведенні(закон розведення Оствальда).
Буферні системи характеризуються величиною рН і буферною ємністю.
Буферна ємність характеризується кількістю молей сильних кислоти чи основи, які при додаванні до буферної суміші змінюють 1літр її на одну одиницю рН. Буферна ємність збільшується при збільшені концентрації обох компонентів і зменшується при розведенні. Буферні розчини з однаковою концентрацією компонентів мають максимальну буферну ємність.
Значення рН у буферних розчинах визначається константами дисоціації слабих кислот чи основ, а також концентраціями компонентів буферної суміші. Для ацетатної буферної суміші константа кислотності:
 .
.
Звідки концентрація іонів гідрогену:
 .
.
У присутності сильного електроліту – солі, дисоціація оцтової кислоти практично подавлена, тому рівноважна концентрація іону [CH3COO-]=Cсол. дорівнює концентрації солі, а рівноважна концентрація кислоти = концентрації кислоти [CH3COOH]=Ck. Враховуючи це, маємо:
 ,
,
 .
.
Для амонійної буферної суміші:
NH4OH NH4+ +OH-,
NH4+ +OH-,
NH4Cl NH4+ + Cl-,
NH4+ + Cl-,
концентрація іонів гідрогену і рН розчину розраховуються за формулами:
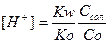 ,
,
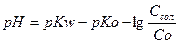 .
.
Буферні розчини широко розповсюджені у природі. Наприклад кров людини має постійне значення рН=7,4, яке утворюється буферною системою крові. Буферні розчини застосовуються при визначенні твердості води комплексонометричним титруванням, при відділенні іонів барію від іонів кальцію, та в багатьох інших випадках.
|
|
|
|
|
Дата добавления: 2014-01-15; Просмотров: 2259; Нарушение авторских прав?; Мы поможем в написании вашей работы!