
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Понятие термодинамического равновесия
|
|
|
|
Понятие термодинамического равновесия
Общие признаки массообменных процессов.
Общие признаки массообменных процессов
- все массообменные процессы применяются для разделения гомогенных смесей компонентов;
- протекают на поверхности раздела фаз (на поверхности паровой (газовой) и жидкой фаз осуществляются процессы перегонки, ректификации, абсорбции; на поверхности раздела двух жидкостей протекает жидкостная экстракция; на поверхности раздела газовой и твердой фаз протекают процессы адсорбции, сушки и т. д.);
- все массообменные процессы протекают при отклонении от равновесного состояния;
- скорость протекания массообменных процессов определяется диффузией распределяемого вещества во взаимодействующих фазах;
- движущая сила массообменных процессов выражается разностью концентраций или парциальных давлений распределяемого вещества;
- все массообменные процессы обратимы. Направление перехода вещества определяется концентрациями вещества в фазах и условиями равновесия;
- переход вещества из одной фазы в другую возникает самопроизвольно и завершается установлением подвижного фазового равновесия.
Механизм процессов переноса массы вещества определяется состоянием поверхности раздела фаз. По этому принципу массообменные процессы подразделяются
- на процессы и аппараты в системах со свободной границей раздела фаз (газ – жидкость, пар – жидкость, жидкость – жидкость);
- на процессы и аппараты в системах с неподвижной поверхностью контакта фаз (газ (пар) – твердое тело, жидкость – твердо тело);
- мембранные процессы, в которых поверхностью раздела фаз является полупроницаемая перегородка (мембрана).
Термодинамическое равновесие рассмотрим на примере разделения аммиачно – воздушной смеси (газовая фаза G) водой (жидкая фаза L), принимая во внимание хорошую растворимость аммиака в воде (воздух в воде растворяется незначительно). При соприкосновении этих фаз молекулы аммиака будут растворяться в воде, т.е. переходить из фазы G в фазу L.
Обозначим
yн – начальная концентрация аммиака в газовой фазе;
xн – начальная концентрация аммиака в жидкой фазе. Предположим, что хн=0.
При взаимодействии фаз G и L концентрация аммиака в газовой фазе уменьшается, а в жидкой – возрастает. С началом растворения аммиака в воде начинается переход части его молекул в обратном направлении. С течением времени скорость перехода аммиака в фазу L (процесс растворения аммиака в воде) снижается, а скорость обратного процесса (выделение аммиака из фазы L и переход в фазу G) возрастает. Такой двусторонний переход будет продолжаться до тех пор, пока скорости переноса в обоих направлениях не станут равными. Если температуры взаимодействующих фаз G и L различны, то имеет место и перенос тепла. При равенстве скоростей прямого и обратного процессов устанавливается термодинамическое равновесие. Система, находящаяся в этом состоянии, называется равновесной.
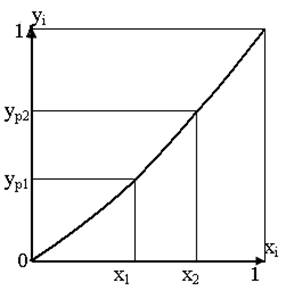
Рисунок 6.1 – Диаграмма равновесия при P=const и t=const
Равновесная система характеризуется равновесными концентрациями распределяемого компонента в фазах (в рассматриваемом примере распределяемым компонентом является аммиак; воздух и вода - распределяющие компоненты или носители).
Таким образом, концентрация аммиака в газовой фазе уменьшается от ун до ур; в жидкой фазе возрастает от 0 до хр.
Между равновесными концентрациями распределяемого компонента в фазах устанавливается взаимосвязь, общий вид которой выражается зависимостью
yр=f(x) или xp=f(y), (6.1)
то есть в условиях равновесия некоторому значению х соответствует определенное значение ур и наоборот.
Графическое изображение зависимостей (6.1) называется линией равновесия, которая является кривой либо в частном случае – прямой линией. На рисунке 6.1 показана кривая равновесия при постоянных значениях давления (P) и температуры (t) для системы с компонентами - носителями.
Отношение равновесных концентраций фаз называется коэффициентом распределения
m=ур/х. (6.2)
Для разбавленных растворов коэффициент распределения является величиной постоянной, поэтому линия равновесия близка к прямой, тангенс угла наклона которой равен величине m.
|
|
|
|
Дата добавления: 2014-01-15; Просмотров: 654; Нарушение авторских прав?; Мы поможем в написании вашей работы!