
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изобарная диаграмма равновесия
|
|
|
|
Диаграммы состояния бинарных систем
Для технических расчетов наиболее важной является диаграмма, связывающая температуру системы с составом паровой и жидкой фаз при постоянном давлении (P =const).
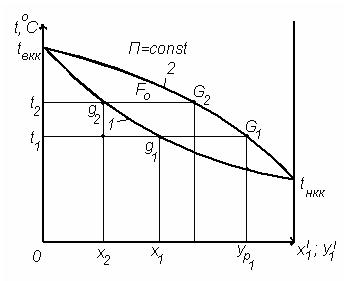 Для построения изобарной диаграммы (рисунок 6.5) определяются температуры кипения низкокипящего компонента (tнкк) и высококипящего (tвкк) при известном значении давления P.
Для построения изобарной диаграммы (рисунок 6.5) определяются температуры кипения низкокипящего компонента (tнкк) и высококипящего (tвкк) при известном значении давления P.
| 1 – линия кипения; 2 – линия конденсации Рисунок 6.5. Изобарная диаграмма равновесия |
Полученный интервал температур кипения компонентов делится на несколько малых (t1,t2,t3 и т.д.) и для каждого значения температур по справочнику либо по уравнению Антуана (уравнение 6.22) определяются давления насыщенного пара компонентов P1 и P 2. Затем по уравнению изотермы жидкой фазы (уравнение 6.35) определяют состав жидкой фазы (х1,х2 и т.д.), соответствующий определенной температуре, а по уравнению (6.31) – состав паровой фазы (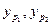 и т.д.) По полученным точкам строят линии кипения жидкости (кривая tнккg1g2tвкк) и конденсации паров (кривая t нкк G1G2t
и т.д.) По полученным точкам строят линии кипения жидкости (кривая tнккg1g2tвкк) и конденсации паров (кривая t нкк G1G2t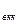 ). Отрезки g1G1; g2G2 и т.д. являются изотермами.
). Отрезки g1G1; g2G2 и т.д. являются изотермами.
Точки, лежащие на линии кипения (g1;g2 и т.д.) соответствуют жидкой фазе, находящейся при температуре кипения. Любая точка, находящаяся ниже этой кривой, характеризует недогретую до температуры кипения жидкую фазу. Аналогично, любая точка, лежащая выше кривой конденсации (линия 2), характеризует систему, состоящую из паровой фазы (перегретый пар). Точки, находящиеся между кривыми кипения и конденсации (например, точка F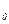 на рисунке 6.5) соответствуют равновесным парожидкостным системам.
на рисунке 6.5) соответствуют равновесным парожидкостным системам.
Изотермы g1G1; g2G2 и т.д., характеризующие состав равновесных жидкой и паровой фаз, называются нодами или конодами.
|
|
|
|
Дата добавления: 2014-01-15; Просмотров: 2219; Нарушение авторских прав?; Мы поможем в написании вашей работы!