
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Перегонка с водяным паром
|
|
|
|
Для разделения нерастворимых в воде жидких смесей используется перегонка с «острым» водяным паром. При этом температура кипения смеси ниже температуры кипения чистых компонентов и является постоянной независимо от состава жидкой смеси, пока в жидкости присутствуют хотя бы следы второго компонента.
Расход острого пара на 1кг перегоняемого i-го компонента сырья из уравнения (6.28)
 . (6.52)
. (6.52)
В действительности расход острого пара больше, поскольку уходящие из перегонного аппарата водяные пары не насыщаются полностью парами отгоняемого компонента, кроме того; уравнение (6.52) не учитывает расход пара на нагрев и испарение сырья. Поэтому перегонка с водяным паром целесообразна только в случае обязательного выделения из относительно нелетучей среды летучих компонентов, не смешивающихся с водой при нормальной температуре.
6.11 Ректификация бинарных смесей
Для получения практически чистых компонентов применяется ректификация. Процесс осуществляется в аппаратах колонного типа, называемых ректификационными колоннами.
Вверху ректификационной колонны поддерживается температура, близкая к температуре кипения низкокипящего компонента, поэтому с верха колонны в паровой фазе отбирается продукт, содержащий в основном НКК. Этот продукт частично или полностью конденсируется, и часть жидкости возвращается в колонну в качестве жидкого орошения (или флегмы). Оставшаяся часть верхнего продукта, называется дистиллятом (Д) и используется по целевому назначению.
В нижней части (в кубе) ректификационной колонны поддерживается температура, близкая к температуре кипения высококипящего компонента, поэтому из куба колонны в жидкой фазе отбирается продукт, содержащий в основном ВКК. Часть этого продукта испаряется и возвращается в колонну в качестве парового орошения. Оставшаяся часть жидкого потока, называемая кубовым остатком (W), используется как целевой продукт.
Таким образом, в ректификационной колонне осуществляется массо- и теплообмен между поднимающимся паром и стекающей жидкостью. Массообмен происходит в результате отличия составов взаимодействующих потоков пара и жидкости от равновесных.
Взаимодействие между потоками пара и жидкости может осуществляться ступенчато на специальных устройствах, называемых тарелками (ректификационные колонны тарельчатого типа), либо непрерывно в слое насадки (ректификационные колонны насадочного типа).
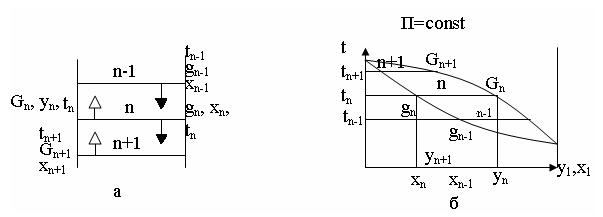 Принцип ректификации рассмотрим на примере тарельчатой колонны по изобарной диаграмме (t-x1y1). В колонне произвольно выделим сечение, включающее три тарелки: верхняя тарелка (n-1), нижняя (n+1) и средняя (или промежуточная) n (рисунок 6.12).
Принцип ректификации рассмотрим на примере тарельчатой колонны по изобарной диаграмме (t-x1y1). В колонне произвольно выделим сечение, включающее три тарелки: верхняя тарелка (n-1), нижняя (n+1) и средняя (или промежуточная) n (рисунок 6.12).

 |
а – часть колонны с тремя тарелками; б – фазовая диаграмма t-xdy
Рисунок 6.12 – Принцип ректификации на изобарной диаграмме
Пары G с содержанием НКК y
с содержанием НКК y поднимаются с тарелки (n+1). С тарелки (n-1) стекает жидкость g
поднимаются с тарелки (n+1). С тарелки (n-1) стекает жидкость g с содержанием НКК x
с содержанием НКК x . Эти потоки неравновесны, так как t
. Эти потоки неравновесны, так как t больше t
больше t . На тарелке n происходит взаимодействие между потоками, сопровождающееся тепло- и массообменном. В результате этого (рисунок 6.12 б)
. На тарелке n происходит взаимодействие между потоками, сопровождающееся тепло- и массообменном. В результате этого (рисунок 6.12 б)
- температура потоков выравнивается (t );
);
- паровая фаза G обогащается низкокипящим компонентом (y
обогащается низкокипящим компонентом (y >y
>y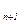 );
);
- жидкая фаза g обогащается высококипящим компонентом (x
обогащается высококипящим компонентом (x <x
<x ).
).
Итак, ректификация – противоточный двухсторонний массообменный процесс, в результате которого паровая фаза обогащается низкокипящим компонентом, а жидкая – высококипящим компонентом.
В производственных условиях ректификация осуществляется при атмосферном и повышенном давлениях, под вакуумом. Под избыточным давлением проводят ректификацию сжиженных газов (разделении кислорода и азота); под вакуумом – разделение высококипящих и нетермостойких веществ, а так же смесей компонентов с близкими температурами кипения. Ректификацию обычно проводят на установках непрерывного действия. Периодическую ректификацию используют в случае часто меняющихся по составу смесей и при небольших производительностях.
6.11.1 Принципиальная схема ректификационной установки
Рассмотрим принципиальную схему ректификационной установки непрерывного действия для разделения бинарной смеси (рисунок 6.13).
Для эффективного процесса ректификации необходимо, чтобы поступающая на разделение смесь подавалась на тарелку, состав паровой и жидкой фаз на которой ближе всего к составу разделяемой смеси при ее однократном испарении, поэтому исходную смесь вводят в то место ректификационной колонны 1, которое соответствует этому условию. Место ввода исходной смеси, нагретой до температуры кипения в подогревателе 2, называют тарелкой питания или питательной тарелкой.

1 – колонна ректификационная; 2 – нагреватель сырья; 3 – дефлегматор; 4 – фазоразделитель; 5 – кипятильник
Рисунок 6.13 – Принципиальная схема ректификационной установки
Место ввода исходной смеси делит ректификационную колонну на две части (секции): верхнюю укрепляющую (или концентрационную) и нижнюю исчерпывающую (или отгонную). В укрепляющей части происходит обогащение поднимающихся паров низкокипящим компонентом, в исчерпывающей – удаление НКК. Поток пара, поднимающегося по ректификационной колонне, поддерживается испарением части кубовой жидкости в кипятильнике 5, а поток жидкости, текущий по колонне вниз – возвратом флегмы, образующейся при конденсации (частичной как на рисунке 6.13 или полной) выходящих из колонны паров в дефлегматоре 3.
Изображенная на рисунке 6.13 ректификационная колонна называется полной. Полная ректификационная колонна позволяет разделить смесь на два материальных потока – дистиллят и кубовую жидкость с высоким выходом целевых продуктов.
В химической технологии нашли применение неполные ректификационные колонны, имеющие зону питания и одну из секций. Укрепляющая колонна позволяет получить в качестве целевого продукта дистиллят с высоким содержанием НКК. При этом исходная смесь непрерывно подается в куб колонны в паровой фазе. Отгонная (или исчерпывающая) обеспечивает в качестве целевого продукта только высококипящий компонент (в виде кубовой жидкости). При этом исходная смесь непрерывно подается в верх ректификационной колонны в жидкой фазе.
6.12 Материальный и тепловой балансы полной ректификационной колонны
Введем обозначения
F– массовый расход сырья, кг/ч;
xF – концентрация НКК (масс. д);
D, yD – соответственно расход дистиллята и концентрация НКК;
W, xw – массовый расход остатка и концентрация НКК;
hF, HD, hw – удельная энтальпия соответственно сырья, дистиллята и остатка, кДж/кг;
Qd – количество тепла, отводимое в парциальном конденсаторе, кВт;
Qв – количество тепла, подводимое в испарителе, кВт.
Уравнение материального баланса можно записать
- по внешним потокам
F=D+W; (6.53)
- по содержанию НКК в потоках
FxF=DyD+WxW. (6.54)
Решая систему уравнений (6.53) и (6.54), получим тождество
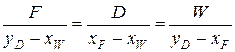 , (6.55)
, (6.55)
из которого определяется выход дистиллята и остатка
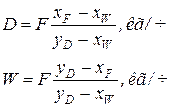 (6.56)
(6.56)
Уравнение теплового баланса имеет вид
QF+QB=QD+QW+Qd, (6.57)
где QF – теплота, вносимая сырьем, кВт;
QD, QW – теплота, отводимая дистиллятом и остатком.
Теплоту, вносимую сырьем и отводимую с дистиллятом и остатком, можно выразить через расход потока и удельную энтальпию. Тогда уравнение теплового баланса можно записать
FhF+QB=DHD+Whw+Qd, (6.58)
которое можно привести к виду
QB-Qd=DHD+Whw-FhF (6.59)
Последнее уравнение показывает, что величины QB и QD взаимосвязаны. С увеличением подвода теплоты в куб колонны (QB) увеличивается и отвод теплоты в верху колонны (QD) и наоборот.
6.13 Анализ работы секций ректификационной колонны
При расчете процесса ректификации вводится понятие теоретической ступени изменения концентраций или теоретической тарелки (ТТ), то есть идеального устройства, на котором достигается равновесие между взаимодействующими паровой и жидкой фазами. Таким образом, потоки, покидающие ТТ, равновесны и составы их можно определить по уравнению равновесия (уравнение Рауля-Дальтона).
Анализ работы секций ректификационной колонны сводится к выводу уравнений, связывающих составы неравновесных потоков в соответствующей секции. При этом вводятся допущения, существенно упрощающие анализ и расчет ректификации
- количество поднимающихся паров (в киломолях) в любом сечении колонны одинаково;
- в дефлегматоре не происходит изменения состава пара. Следовательно состав пара, уходящего из ректификационной колонны равен составу дистиллята. Если весь пар конденсируется в дефлегматоре, то это положение полностью соответствует реальным условиям;
- при испарении жидкости в кипятильнике не происходит изменения ее состава. Следовательно, состав пара, образующегося в кипятильнике, соответствует составу кубового остатка;
- теплоты смешения компонентов разделяемой смеси равны 0.
Поскольку условия работы укрепляющей и исчерпывающей секции ректификационной колонны различны, то рассмотрим их отдельно.
 В укрепляющей секции колонны возьмем произвольное сечение А – А, включающее верхнюю часть колонны (рисунок 6.14). В сечение А – А с тарелки i+1 входит паровой поток Gi+1 состава yi+1 по НКК. Из выделенного сечения А – А уходит поток жидкости gi состава xi и поток дистиллята D состава yD.
В укрепляющей секции колонны возьмем произвольное сечение А – А, включающее верхнюю часть колонны (рисунок 6.14). В сечение А – А с тарелки i+1 входит паровой поток Gi+1 состава yi+1 по НКК. Из выделенного сечения А – А уходит поток жидкости gi состава xi и поток дистиллята D состава yD.
Запишем уравнения материального баланса для сечения А – А
| Рисунок 6.14 – К анализу укрепляющей секции ректификационной колонны |
 , (6.60)
, (6.60)
откуда получим выражение
 .
.
Разделив числитель и знаменатель слагаемых правой части на величину D и обозначив комплекс gi/D=R, получаем уравнение, связывающее составы неравновесных потоков укрепляющей секции колонны
 . (6.61)
. (6.61)
 В уравнении (6.61) R – флегмовое число. Предполагая, что флегмовое число по высоте укрепляющей секции колонны остается неизменным, в координатах у – х уравнение (6.61) отображается прямой линией, которая называется рабочей линией укрепляющей части колонны. При этом R/(R+1), есть тангенс угла наклона β рабочей линии к оси абсцисс, а комплекс yD/(R+1) – отрезок, отсекаемый рабочей линией от оси ординат. Кроме того при x
В уравнении (6.61) R – флегмовое число. Предполагая, что флегмовое число по высоте укрепляющей секции колонны остается неизменным, в координатах у – х уравнение (6.61) отображается прямой линией, которая называется рабочей линией укрепляющей части колонны. При этом R/(R+1), есть тангенс угла наклона β рабочей линии к оси абсцисс, а комплекс yD/(R+1) – отрезок, отсекаемый рабочей линией от оси ординат. Кроме того при x =y
=y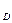 , y=y
, y=y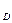 , то есть рабочая линия укрепляющей части колонны пересекает диагональ с ординатой y
, то есть рабочая линия укрепляющей части колонны пересекает диагональ с ординатой y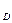 . (рисунок 6.15 а).
. (рисунок 6.15 а).
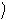 | |||
|
Рисунок 6.15 – К выводу уравнений рабочих линий верхней (а) и нижней (б) секций ректификационной колонны
При выводе уравнений рабочей линии исчерпывающей секции колонны записываем уравнение материального баланса для произвольно выбранного сечения В – В, включающего низ колонны (рисунок 6.16).
В сечении В – В входит стекающая с тарелки n жидкость gn с концентрацией НКК xn.
Выделенное сечение покидают поток пара Gn+1, поднимающийся с тарелки (n+1) состава yn+1 и кубовый остаток W состава xw по НКК.
Тогда
gn=W+Gn+1,
gnxn=Wxw+Gn+1yn+1. 6.62)
откуда
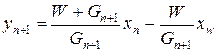 ,
,
 Разделив числитель и знаменатель вычитаемых правой части на величину W и обозначив комплекс Gn+1/W=П, получим уравнение, связывающее составы неравновесных потоков исчерпывающей секции колонны
Разделив числитель и знаменатель вычитаемых правой части на величину W и обозначив комплекс Gn+1/W=П, получим уравнение, связывающее составы неравновесных потоков исчерпывающей секции колонны
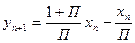 . (6.63)
. (6.63)
| Рисунок 6.16 – К анализу исчерпывающей секции колонны |
В уравнении (6.63) П – паровое число. Принимая, что паровое число по высоте исчерпывающей секции колонны остается неизменным, в координатах у-х уравнение (6.62) отображается прямой линией, которая проходит через точку W, лежащую на диагонали с абсциссой х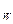 при xn=xw, yn+1=xw, и отсекает на верхней стороне диаграммы у-х (при уn+1=1) отрезок (П+xw)/(П+1) (рисунок 6.15 б).
при xn=xw, yn+1=xw, и отсекает на верхней стороне диаграммы у-х (при уn+1=1) отрезок (П+xw)/(П+1) (рисунок 6.15 б).
6.14 Расчет числа теоретических ступеней изменения концентраций в ректификационной колонне
Известно два основных метода расчета ректификационных колонн: графоаналитический (часто называемый графическим) для расчета бинарной ректификации и аналитический. Однако независимо от метода расчет сводится к последовательному решению (графически либо аналитически) уравнений равновесных и неравновесных потоков соответствующей части колонны.
Рассмотрим графический метод расчета ректификационной колонны по диаграмме равновесных составов.
По известному составу дистиллята (y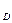 ) и остатка (x
) и остатка (x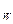 ) и заданным значениям флегмового (R) и парового (П) чисел на диаграмму у-х наносим рабочие линии укрепляющей (линия АD) и исчерпывающей (линия WC) секций ректификационной колонны в соответствии с уравнениями (6.61) и (6.63) (рисунок 6.17).
) и заданным значениям флегмового (R) и парового (П) чисел на диаграмму у-х наносим рабочие линии укрепляющей (линия АD) и исчерпывающей (линия WC) секций ректификационной колонны в соответствии с уравнениями (6.61) и (6.63) (рисунок 6.17).


а – диаграмма у-х; б – равновесные (D и g; G1 и g1; и т. д.) и неравновесные (G1 и g; G2 и g1), потоки пара и жидкости
Рисунок 6.17 – Определение числа теоретических ступеней изменения концентраций в ректификационной колонне
Если в питательной секции происходит однократное испарение сырья с образованием равновесных парового G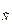 и жидкого g
и жидкого g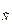 потоков с концентрацией низкокипящего компонента у
потоков с концентрацией низкокипящего компонента у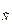 и х
и х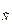 соответственно, т.е.
соответственно, т.е.
FxF=Gcyc+gcxc,
причем относительное количество паровой фазы G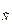 характеризуется долей отгона e
характеризуется долей отгона e
е=Gc/F,
то на диаграмму у-х наносится линия ey, связывающая составы потоков, образующихся в зоне питания. Линия ey является геометрическим местом точек пересечения рабочих линий укрепляющей и исчерпывающей секций колонны и описывается уравнением
ey=-(1-e)x+xF. (6.64)
В координатах у-х уравнение (6.64) представляет прямую линию F*C, проходящую через точку F, лежащую на диагонали с абсциссой хF (при x=xF, y=xF), и точку С, отсекающую на оси абсцисс отрезок, уравнение которого
xF/(1-e).
Из точки F* проводим линии, параллельные осям координат и получаем треугольник nF*m, с помощью которого рассчитывается питательная секция колонны.
Расчет числа тарелок по диаграмме составов проводится в одном наравлении – или сверху вниз, или снизу вверх.
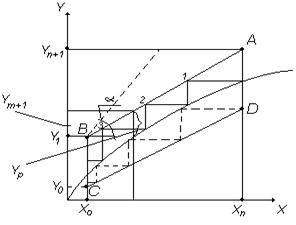
Рассчитаем количество тарелок в колонне, начиная с укрепляющей секции (рисунок 6.17,б).
Точка 1 на кривой равновесия (рисунок 6.17,а) характеризует равновесные потоки D и g, покидающие дефлегматор. Положение точки 1 устанавливаем, проводя из точки D (x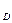 , y
, y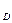 ) горизонталь до пересечения с кривой равновесия.
) горизонталь до пересечения с кривой равновесия.
Опуская вертикаль из точки 1 на рабочую линию укрепляющей части колонны, получаем точку 2, характеризующую неравновесные потоки G1 и g с концентрацией НКК соответственно у1 и х. Из точки 2 проводим горизонталь до кривой равновесия и определяем равновесные потоки, уходящие с первой тарелки (потоки G1 и g1) и так далее.
Итак, определение числа тарелок в укрепляющей части колонны сводится к построению ступенчатой ломаной линии между кривой равновесия и рабочей линией верха колонны.
Построение ступенчатой линии в укрепляющей части колонны заканчиваем, когда линия, параллельная оси у попадает в зону треугольника nF*m. Это будет последняя тарелка укрепляющей части колонны.
Затем строим ломаную ступенчатую линию между кривой равновесия и рабочей линией низа до тех пор, пока не достигнем точки W с координатами xw, y=xw.
Количество теоретических тарелок N1 и N2 в укрепляющей и исчерпывающей секциях определяется числом ступеней ломаных линий.
Метод расчета числа теоретических тарелок по диаграмме составов при условии постоянства значений парового и флегмового чисел называется методом Мак-Кэба и Тиле.
6.15 Режимы орошения ректификационной колонны
В ректификационной колонне можно выделить
- режим минимального орошения;
- режим рабочего орошения;
- режим полного (максимального) орошения.
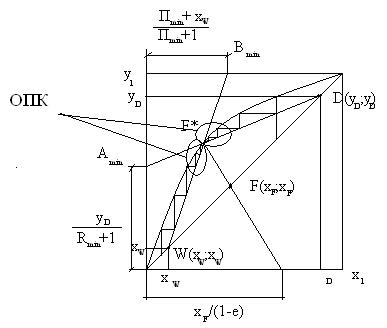
6.15.1 Режим минимального орошения
При режиме минимального орошения на орошение колонны подается минимальное количество флегмы, которая образуется за счет минимального отвода тепла. Этот режим характеризуется минимальным флегмовым числом, которое можно определить по выражению
 , (6.65)
, (6.65)
ус и хс – координаты точки F* (см. рисунок 6.17,а).
 | |||
 | |||
 Если укрепляющая секция колонны работает в режиме минимального орошения, то и отгонная секция будет работать в этом же режиме, который характеризуется минимальным паровым орошением, т.е. образующими при минимальном подводе тепла и куб колонны минимальное паровое число определяется по уравнению
Если укрепляющая секция колонны работает в режиме минимального орошения, то и отгонная секция будет работать в этом же режиме, который характеризуется минимальным паровым орошением, т.е. образующими при минимальном подводе тепла и куб колонны минимальное паровое число определяется по уравнению
 . (6.66)
. (6.66)
| Рисунок 6.18 – Изображение режима минимального орошения на диаграмме у-х |
При минимальном орошении вблизи зоны питания образуются области предельных концентраций (ОПК), т. е. области, в которых изменение концентрации при переходе от одной тарелки к другой не наблюдается. При этом число теоретических тарелок будет бесконечно большим (NTT→∞).
Так как NTT→∞, то в этом режиме реальная колонна не работает, т. е. для реальной колонны флегмовое и паровое число должны превышать их минимальное значение. Это превышение характеризуется кратностью орошения
 , (6.67)
, (6.67)
значение которой находится в пределах от 1,1 до 1,5.
6.15.2 Режим полного орошения. Графическое, аналитическое определения числа теоретических тарелок при режиме полного орошения.
При режиме максимального орошения колонны флегмовое и паровое числа будут максимальными., т.е.
П→∞; R→∞.
Колонна работает «сама на себя», без отбора дистиллята ( ) и остатка (
) и остатка ( ).
).
При режиме максимального орошения рабочие линии укрепляющей и исчерпывающей секций колонны совпадают с линией равного состава (диагональю диаграммы у-х). Поэтому расчет числа теоретических тарелок сводится к построению ступенчатой ломаной линии между кривой равновесия и диагональю между точками D (y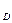 ; y
; y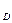 ) и W (x
) и W (x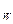 , x
, x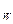 ).
).


 Графический расчет числа ТТ при полном орошении показан на рисунке 6.19. Как видно из рисунка, число теоретических тарелок при максимальном орошении колонны будет минимальным (N
Графический расчет числа ТТ при полном орошении показан на рисунке 6.19. Как видно из рисунка, число теоретических тарелок при максимальном орошении колонны будет минимальным (N ). yD
). yD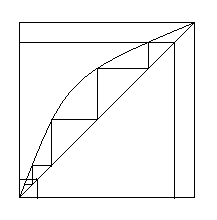
Число теоретических тарелок при максимальном орошении можно определить по уравнению Фенске-Андервуда
| Рисунок 6.19 – Определение числа теоретических ступеней изменения концентраций при максимальном орошении в колонне по диаграмме у-х |
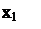
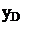
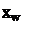
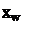

 , (6.68)
, (6.68)
где α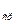 – средний коэффициент относительной летучести.
– средний коэффициент относительной летучести.
Режим полного орошения позволяет определить наибольшую четкость разделения.
Зная Nmin, можно определить число теоретических тарелок при рабочем режиме (по графику Джиллиленда).
6.16 Расчет геометрических размеров колонны
6.16.1 Расчет диаметра колонны
Диаметр колонны определяется по выражению
 , (6.69)
, (6.69)
где V - объемный расход паров в наиболее нагруженном сечении колонны, м3/с;
G - массовый расход паров в том же сечении, кг/с;
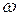 q, Gq - соответственно линейная (м/с) и массовая (кг/м2с) допустимые скорости паров в том же сечении колонны.
q, Gq - соответственно линейная (м/с) и массовая (кг/м2с) допустимые скорости паров в том же сечении колонны. 
Массовый расход паров в верхнем сечении колонны рассчитывается по уравнению материального баланса для данного сечения
G = D + q = D(1 + R) кг/ч. (6.70)
Для нижнего сечения колонны массовый расход пара
G = WП кг/ч. (6.71)
Дальнейший расчет ведется по большему из полученных значений расхода паров.
Объемный расход паров определяется по выражению
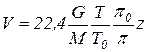 , (6.72)
, (6.72)
где М - мольная масса смеси, кг/кмоль;
Т, 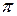 - соответственно температура (К) и давление (МПа) в рассчитываемом сечении колонны;
- соответственно температура (К) и давление (МПа) в рассчитываемом сечении колонны;
Т0,  - температура и давление при нормальных условиях (Т0 = 273К;
- температура и давление при нормальных условиях (Т0 = 273К;  = 0,1 МПа)
= 0,1 МПа)
z - коэффициент сжимаемости. При 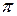 < 0,5 МПа можно принять z=l.
< 0,5 МПа можно принять z=l.
Допустимая линейная скорость паров в колонне определяется по выражению
 , (6.73)
, (6.73)
и массовая скорость по уравнению
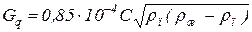 , (6.74)
, (6.74)
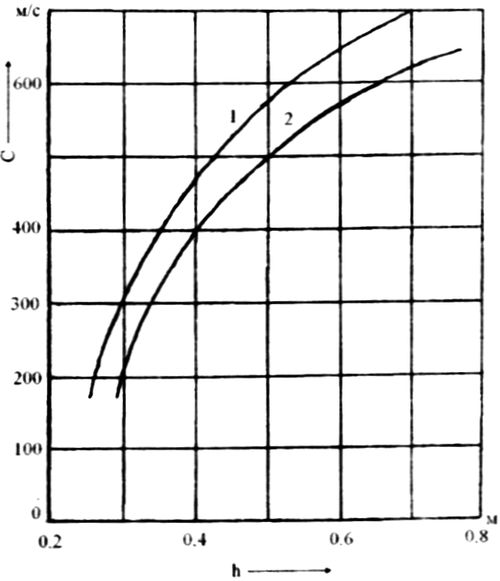
где С - коэффициент, величина которого зависит от конструкции тарелки, расстояния между тарелками и поверхностного натяжения жидкости (рисунок 6.20);
 - плотность пара и жидкости соответственно, кг/м.3
- плотность пара и жидкости соответственно, кг/м.3
Плотность паровой фазы при данной температуре Т рассчитывается как
 . (6.75)
. (6.75)
Плотность жидкости при температуре Т определяется по формуле
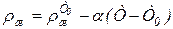 , (6.76)
, (6.76)
где Т0 - произвольная начальная температура (обычно 273 или 293 К);
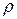 ж - плотность смеси при температуре Т, зависящая от плотности индивидуальных компонентов р, и определяемая по выражению
ж - плотность смеси при температуре Т, зависящая от плотности индивидуальных компонентов р, и определяемая по выражению
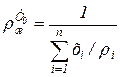 ; (6.77)
; (6.77)
для бинарной системы
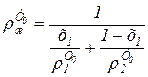 , (6.78)
, (6.78)
где а - средняя температурная поправка плотности на один градус в пределах температур от Т0 доТ, (г/см ).
).
а = 0,001828 – 0,00132 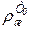 , 6.78)
, 6.78)
Значение диаметра колонны округляется в соответствии с существующими нормами (ГОСТ 9617-61).
Стандартом предусмотрены следующие диаметры колонных аппаратов
- от 1000 до 4000 мм - через каждые 200 мм, т.е. 1200, 1400,1600 и т.д.;
- от 4000 - через каждые 500 мм.
1 – при  =20∙10
=20∙10 Н/м; 2 – при
Н/м; 2 – при  =10∙10
=10∙10 Н/м
Н/м
Рисунок 6.20 – Значение коэффициента С при различных величинах поверхностного натяжения ( )
)
6.16.2 Определение высоты колонны
Рабочая высота колонны (рисунок 6.21) рассчитывается по выражению
 , (6.79)
, (6.79)
где  - число теоретических тарелок в концентрационной и отгонной секциях;
- число теоретических тарелок в концентрационной и отгонной секциях;
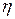 - эффективность (к.п.д.) тарелки;
- эффективность (к.п.д.) тарелки;
h - расстояния между тарелками: h = 0.3... 0, 7 м (DK < 0,8 м, h = 250-300 мм; 0,8 < DK < 6 м, h = 450-600мм; Dk > 6 м; h = 600-700мм);
h - расстояние между верхним днищем и верхней тарелкой; h
- расстояние между верхним днищем и верхней тарелкой; h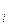 =1,0... 1,3м;
=1,0... 1,3м;
h2 - расстояние между тарелками в эвапарационном пространстве (высота зоны питания); h2 = 1,0... 1,5 м;
h - расстояние между нижним днищем и нижней тарелкой; h3 = 1,0... 1,5 м.
- расстояние между нижним днищем и нижней тарелкой; h3 = 1,0... 1,5 м.
6.16.3 Расчет штуцеров
Расчет штуцеров ректификационной колонны (для ввода сырья А, вывода дистиллята Б и остатка В, ввода жидкого Г и парового Е орошения) проводится по выражению
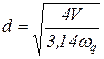 , (6.80)
, (6.80)
где V - объемный расход потока в соответствующем штуцере, м3 /с;
 q - допустимая линейная скорость движения потока, м/с. Принимается в зависимости от агрегатного состояния потоков (пар, жидкость) и способа перемещения (движение самотеком, подача насосом и т.д.).
q - допустимая линейная скорость движения потока, м/с. Принимается в зависимости от агрегатного состояния потоков (пар, жидкость) и способа перемещения (движение самотеком, подача насосом и т.д.).
Объемный расход потока определяется по выражению
 , (6.81)
, (6.81)
где G - массовый расход потока пара или жидкости, проходящий через рассчитываемый штуцер, кг/ч;
| Рисунок 6.21 – Схема для расчета рабочей высоты колонны |
 - плотность потока. Полученное значение диаметра штуцера округляется согласно существующим нормалям. Предусмотрен следующий ряд условных диаметров штуцеров: 10, 15, 20, 25, 32, 40, 50, 70, 80, 100, 125, 150, 175, 200, 225, 250,275, 300, 350,400, 450... мм.
- плотность потока. Полученное значение диаметра штуцера округляется согласно существующим нормалям. Предусмотрен следующий ряд условных диаметров штуцеров: 10, 15, 20, 25, 32, 40, 50, 70, 80, 100, 125, 150, 175, 200, 225, 250,275, 300, 350,400, 450... мм.
6.17 Азеотропная и экстрактивная ректификация
Применение разделяющего агента для ректификации близкокипящих компонентов
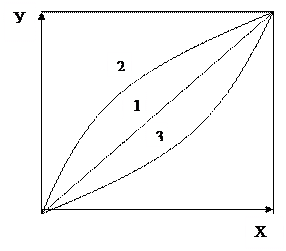
Легкость разделения компонентов при ректификации зависит от величины коэффициента относительной летучести α=P1/P2, чем больше разница в температурах кипения компонентов, тем α больше.
Для компонентов с близкими температурами кипения величина а незначительно отличается от 1 и процесс разделения компонентов ректификацией затрудняется: для обеспечения заданной чёткости ректификации требуется большее число тарелок и большее флегмовое число.
При разделении близкокипящих смесей даже при большом числе тарелок и большом флегмовом числе трудно достигнуть высокой чёткости разделения.

Кривые на графике показывают, что необходимое число тарелок при данной чёткости разделения резко уменьшается при увеличении коэффициента α от 1,03 до 1,2. Так, при Е=10 изменение α в этих пределах приводит к уменьшению числа тарелок от 120 до 13. При дальнейшем увеличении α число тарелок сокращается в меньшей степени.
Чем выше чёткость разделения, тем выше значения фракционирующего фактора и тем более эффективно оказывает влияние увеличение коэффициента относительной летучести на число тарелок в колонне.
Величина коэффициента относительной летучести может быть увеличена путём изменения давления в ректификационной колонне.
Понижение давления при ректификации будет повышать эффективность этого процесса для тех систем, для которых уменьшение давления сопровождается увеличением коэффициента относительной летучести и наоборот.
Для некоторых смесей величина α может быть увеличена путём добавления к этой смеси третьего компонента, называемого разделяющим агентом и обладающего различной растворимостью по отношению к разделяемым компонентам.
Из-за различной растворимости разделяемых компонентов в третьем они по разному отклоняются от законов идеальных растворов и ведут себя поэтому как компоненты, в большей степени отличающиеся по летучести, чем это было в отсутствии третьего компонента.
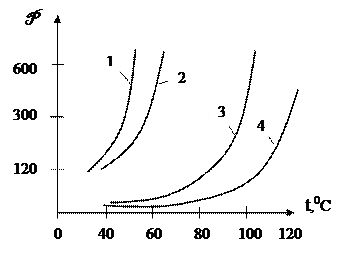 |
1-бензол; 2-циклогексан; 3- циклогексан и анилин; 4-бензол и анилин
Рисунок 6.23 - Зависимость давления насыщенных паров бензола, циклогексана в чистом виде и в присутствии разделяющего агента (анилина)
На рисунке 6.23 представлены кривые давления насыщенных паров бензола (tK = 80,40С) и циклогексана (tK = 80,740С) в чистом виде и в смеси их с 80% анилина, который является для них разделяющим агентом. В отсутствии анилина давление насыщенных паров бензола и циклогексана весьма близки между собой и поэтому разделение этих компонентов ректификацией в обычных условиях практически невозможно. В присутствии анилина давление паров их существенно различаются, причём циклогексан (менее растворимый в анилине) имеет значительно большее давление насыщенных паров, чем бензол, который хорошо растворяется в анилине.
Значит, в присутствии анилина смесь бензола и циклогексана разделить сравнительно легче ректификацией, циклогексан в этих условиях является НКК, а бензол - ВКК.
Для смесей, отклоняющихся от законов идеальных растворов, величина α определяется выражением
α = γ1 P1/ γ2 P2, (6.83)
где γ1 и γ2 - коэффициенты активности разделяемых компонентов, характеризующие степень отклонения их от законов идеальных растворов.
При наличии разделяющего агента подлежащие ректификации компоненты из-за различной их растворимости по разному отклоняются от законов идеальных растворов и коэффициенты активности 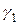 и
и 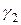 у них различны поэтому даже при P1= P2 коэффициент относительной летучести больше единицы.
у них различны поэтому даже при P1= P2 коэффициент относительной летучести больше единицы.
Таким образом, для того, чтобы обеспечить разделение близкокипящих компонентов, необходимо подобрать такой разделяющий агент, в присутствии которого величины 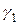 и
и 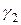 существенно различаются. Этот эффект может быть обеспечен при условии, если разделяемые компоненты отличаются по своей химической структуре, чем и обуславливается их различная растворимость и степень отклонения от законов идеальных растворов.
существенно различаются. Этот эффект может быть обеспечен при условии, если разделяемые компоненты отличаются по своей химической структуре, чем и обуславливается их различная растворимость и степень отклонения от законов идеальных растворов.
Ректификация в присутствии разделяющего агента применяется при разделении близкокипящих смесей ароматических, парафиновых и нафтеновых углеводородов, имеющих близкие температуры кипения, парафиновых и непредельных углеводородов (выделение изо- и н-бутана из смеси с бутенами и бутадиеном) и т.п.
При существенном различии 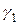 и
и 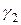 более летучим может оказаться вещество, имеющее более высокую температуру кипения. Высокое значение α может быть достигнуто и при P1>P2, если
более летучим может оказаться вещество, имеющее более высокую температуру кипения. Высокое значение α может быть достигнуто и при P1>P2, если 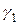 и
и 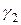 (α = γ1 P1/ γ2 P2)
(α = γ1 P1/ γ2 P2)
В зависимости от летучести разделяющего агента по отношению к летучести разделяемых компонентов процесс подразделяется на азеотропную и экстрактивную ректификацию. При азеотропной ректификации летучесть разделяющего агента сравнительно велика, поэтому в ректификационной колонне основная его масса отбирается в паровой фазе сверху колонны вместе с ректификатом.
При экстрактивной ректификации разделяющий агент отличается сравнительно низкой летучестью и отбирается с низа колонны вместе с остатком в жидкой фазе.
Рассмотрим принципиальные схемы азеотропной и экстрактивной ректификации на примере разделения парафиновых и ароматических углеводородов
Применение азеотропной и экстрактивной ректификации в промышленности предопределяется главным образом экономикой процесса. Эксплуатационные затраты на ректификацию с разделяющим агентом в значительной степени зависят от относительного количества разделяющего агента, подаваемого в ректификационную колонну.
С увеличением удельного расхода разделяющего агента растут энерго затраты на нагрев, а при азеотропной ректификации - на испарение агента в виде расхода воды на охлаждение и т.д. Расход разделяющего агента зависит главным образом от состава сырья.
При азеотропной ректификации расход разделяющего агента возрастает при увеличении концентрации в сырье тех компонентов, которые отбираются в качестве ректификата с верха колонны. Так, при разделении смеси парафиновых и ароматических углеводородов расход разделяющего агента при азеотропной ректификации возрастает при увеличении концентрации в сырье парафиновых углеводородов.
|
|
|

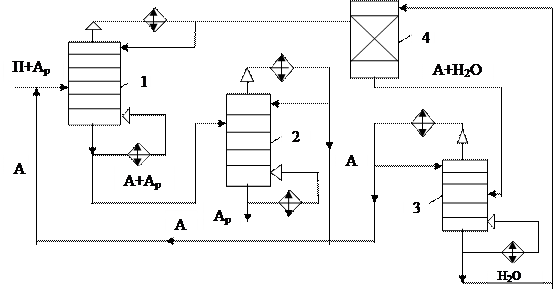 |
1,2,3 – полные ректификационные колонны; 4 – противоточный экстрактор. Разделяющий агент – спирт
Рисунок 6.24 – Принципиальная схема азеотропной ректификации
 | |||||
 | |||||
| |||||




 | |||
| |||
 |
При экстрактивной ректификации, наоборот, расход разделяющего агента увеличивается при увеличении в сырье концентрации компонентов, отбираемых с низа колонны, т.е. при увеличении концентрации ароматических углеводородов.
В связи с этим азеотропная ректификация применяется при сравнительно небольшой концентрации в сырьё компонентов отбираемых в виде остатка с низа колонны.
Кроме того, в случае азеотропной ректификации тепло расходуется на нагрев и испарение разделяющего агента; при экстрактивной ректификации тепло расходуется только на нагрев третьего компонента.
При выборе типа разделяющего агента надо учесть, что при экстрактивной ректификации температура в колонне выше, чем при азеотропной ректификации.
Требования к разделяющему агенту
Разделяющий агент при азеотропной и экстрактивной ректификации должен удовлетворять следующим основным требованиям
- обеспечивать возможно большее повышение коэффициента α для разделяемых компонентов;
- сравнительно легко отделяться от компонентов исходной разделяемой
смеси ректификацией, экстракцией или любым другим способом;
- хорошо растворять разделяемые компоненты, так как при температурном режиме ректификационной колонны образование двух жидких фаз на тарелках колонны может привести к ухудшению процесса разделения;
- быть термически стабильным, не реагировать с компонентами смеси, не вызывать коррозии аппаратуры, не быть токсичным и иметь не высокую стоимость.
При разделении парафиновых и ароматических углеводородов в случае азеотропной ректификации в качестве разделяющего агента применяется метиловый или этиловый спирт.
При экстрактивной ректификации в качестве разделяющего агента применяется фенол, фурфурол и др.
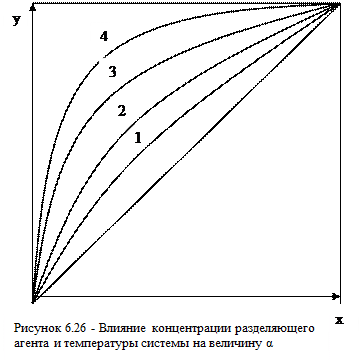
Величины коэффициентов γ и α зависят от свойств компонентов, входящих в состав системы, концентрации разделяющего агента и температуры, а => и давления системы. С увеличением концентрации разделяющего агента в жидкой фазе γ и α растут. В качестве примера на рисунке 6.26 даны кривые равновесия для системы толуол – метил- циклогексан при различных концентрациях фенола
1. без фенола;
2. 25% фенола;
3. 50% фенола; 4. 75% фенола.
Составы жидкой и паровой фаз даны для смеси толуола и парафиново- го углеводорода без учёта концентрации разделяющего агента.
| |||
 | |||
температуры растёт.
Для некоторых систем (метилгиклогексан-гептан) величина γ и α с уменьшением температуры понижается.
Смеси, у которых α уменьшается с понижением температуры подчиняются той же закономерности в присутствии разделяющего агента.
Изменение температуры системы соответственно обуславливает изменение давления, поэтому изменение температурного режима в ректификационной колонне с разделяющим агентом влияет на величину α в том же направлении, что и изменение давления.
Несмотря на широкое распространение процессов азеотропной и экстрактивной ректификации, до настоящего времени нет достаточно надёжных методов расчёта колонны для этих процессов.
Трудность выполнения подобных расчётов объясняется тем, что вещества участвующие в процессе ректификации, существенно отклоняются от законов идеальных растворов.
Существующие методы расчёты коэффициента γ сложны и требуют экспериментального определения ряда величин, входящих в состав расчётных уравнений. По этой причине для расчёта азеотропной и экстрактивной ректификации обычно используют опытные данные.
6.18 Абсорбция. Общие сведения о процессе и область его применения. Принципиальная схема абсорбционно-десорбционной установки
В системе, состоящей из газа и соприкасающейся с ним жидкости, молекулы газа, ударяющийся о поверхность жидкости, растворяются в ней. Эти растворяемые молекулы, продолжая двигаться, частично возвращаются в газовую фазу, а частично остаются в жидкой фазе. Растворение молекул газа в жидкости будет продолжаться до достижения состояния равновесия. Концентрация газа, растворенного в жидкой фазе, зависит от парциального давления над поверхностью жидкости.
Согласно правилу фаз Гиббса система, состоящая из жидкости и растворенного в ней газа, имеет две степени свободы
С=К+2-Ф=2+2-2=2 (6.84)
Следовательно, состояние системы определяется температурой и давлением. При постоянной температуре растворяемость газа зависит от давления системы.
По закону Генри растворимость газа в жидкости прямо пропорциональна его парциальному давлению
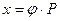 , (6.85)
, (6.85)
 , (6.86)
, (6.86)
где х - концентрация газа, растворенного в жидкости;
 - парциальное давление газа над жидкостью;
- парциальное давление газа над жидкостью;
 - const Генри;
- const Генри;
 - коэффициент, зависящий от свойств газа и жидкости.
- коэффициент, зависящий от свойств газа и жидкости.
Основное уравнение равновесия (закон Дальтона)
 , (6.87)
, (6.87)
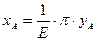 , (6.88)
, (6.88)
 (6.87)
(6.87)
 - коэффициент распределения или const фазового равновесия (6.88)
- коэффициент распределения или const фазового равновесия (6.88)
 (6.89)
(6.89)
С повышением температуры константа m как правило, увеличивается, следовательно, растворимость газа снижается. (Исключение составляют растворимости азота и водорода в углеводородах, у которых растворимость увеличивается с повышением температуры)
Абсорбция – процесс разделения газовых смесей путем избирательного поглощения отдельных компонентов смеси жидким поглотителем – абсорбентом.
Поглощение газа может происходить либо за счет его растворения в абсорбенте, либо в результате его химического взаимодействия с абсорбентом. В первом случае процесс называют физической абсорбцией, а во втором – хемосорбцией. Возможно также сочетание обоих механизмов процесса. Поглощаемые компоненты газовой смеси условимся называть абсорбтивом, непоглощаемые инертами.
В химической технологии абсорбция используется
- для получения целевых продуктов (абсорбция газообразного HCl водой в производстве соляной кислоты и т.д.)
- для выделения ценных компонентов газовых смесей (бутан-бутиленовой фракции из контактного газа в производстве СК, ацетилена из газов крекинга и т.д.);
- для удаления вредных примесей из газовых смесей.
Механизм процесса абсорбции состоит в следующем. На поверхности раздела фаз имеются два пограничных слоя – жидкий и газообразный. Молекула газа, прежде чем проникнуть в толщу жидкости, должна пройти эти два слоя. Перемещение молекул через газовую и жидкую пленку может происходить только путем диффузии; скорость диффузии зависит от разности парциальных давлений газа в общей массе и в пленке. Эта разность является движущей силой процесса абсорбции.
Если парциальное давление или концентрация компонента в газовой фазе будет больше чем жидкости – процесс абсорбции; если концентрация компонентов в жидкой фазе больше, чем в газовой – процесс десорбции.
Сравним процессы абсорбции и ректификации.
Общее между ними
применяются для разделения смесей;
относятся к массообменным процессам;
движущая сила – разность парциальных давлений или концентраций.
Различия
- ректификация – двухсторонний массообменный процесс: паровая фаза обогащается НКК, а жидкая ВКК.
- абсорбция – основной массообменный процесс за счет перехода каких-то компонентов из газовой фазы в жидкую. При этом считаем, что летучесть абсорбента мала, т.е. нет перехода компонентов из жидкой фазы в газовую.
- абсорбция является процессом избирательным. Каждый абсорбент обладает способностью в заметных количествах поглощать одни компоненты, тогда как другие компоненты поглощаются незначительно или вовсе не поглощаются. Большое влияние на процесс абсорбции оказывают также температура и давление.
- в процессе абсорбции газов жидкостью выделяется тепло, называемое теплотой абсорбции. При отсутствии химического взаимодействия между абсорбентом и абсорбируемым газом теплота абсорбции численно равна скрытой теплоте конденсации. В случае химического взаимодействия необходимо также учитывать теплоту реакции. Теплоту абсорбции необходимо отводить, т.к повышение температуры абсорбентов резко ухудшает процесс абсорбции.
На рисунке 6.27 изображена принципиальная схема абсорбционно-десорбционной установки
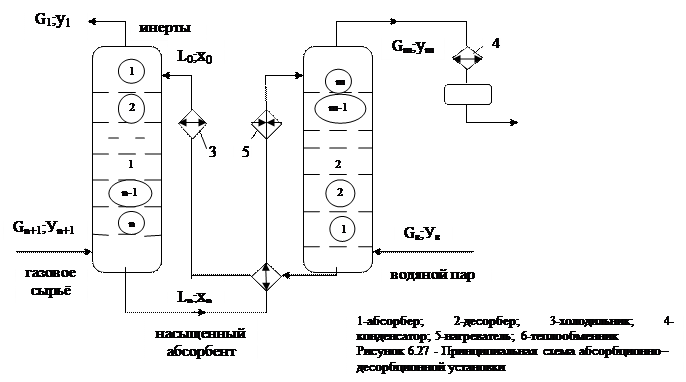
Расчёт процессов абсорбции – десорбции ведётся по относительным концентрациям, т.е. концентрация по отношению компонента в каком-то определенном потоке.
Введём обозначения
 - расход газового сырья;
- расход газового сырья;
 - относительная концентрация извлекаемого компонента в сырье;
- относительная концентрация извлекаемого компонента в сырье;
 - расход абсорбента;
- расход абсорбента;
 - относительная концентрация извлекаемого компонента в абсорбенте;
- относительная концентрация извлекаемого компонента в абсорбенте;
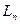 - расход насыщенного абсорбента;
- расход насыщенного абсорбента;
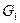 - расход инертов;
- расход инертов;
 - относительная концентрация извлекаемого компонента в инертах;
- относительная концентрация извлекаемого компонента в инертах;
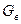 - расход десорбирующего агента;
- расход десорбирующего агента;
 - относительная концентрация извлекаемого компонента в десорбирующем агенте;
- относительная концентрация извлекаемого компонента в десорбирующем агенте;
Выразим относительную концентрацию через абсолютную
 , (6.90)
, (6.90)
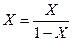 , (6.91)
, (6.91)
 , (6.92)
, (6.92)
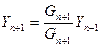 , (6.93)
, (6.93)
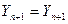 (6.94)
(6.94)
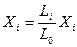 , (6.95)
, (6.95)
 , (6.96)
, (6.96)
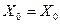 (6.97)
(6.97)
Основные показатели абсорбции
Основными показателями абсорбции являются коэффициент извлечения и эффективность извлечения.
Коэффициент извлечения  - отношение количества поглощенного компонента к его содержанию в исходной смеси
- отношение количества поглощенного компонента к его содержанию в исходной смеси
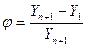 (6.98)
(6.98)
При полном извлечении 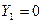 . Тогда
. Тогда  . Во всех остальных случаях
. Во всех остальных случаях  <1.
<1.
Эффективность извлечения 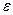 - отношение количества поглощенного компонента к теоретическому, достигаемому в условиях равновесия между уходящим из абсорбента газом и вводимым абсорбентом
- отношение количества поглощенного компонента к теоретическому, достигаемому в условиях равновесия между уходящим из абсорбента газом и вводимым абсорбентом
 , (6.99)
, (6.99)
где Y0 – относительная концентрация извлекаемого компонента в газовом потоке, равновесном входящему абсорбенту.
С учётом уравнения (6.89) можно записать
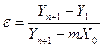 , (6.100)
, (6.100)
Х0 показывает степень регенерации. Если регенерация 100%, то Х0=0.
При Х0=0; Y=0, то ε=φ. Во всех других случаях ε>φ.
Абсорбенты, применяемые в процессе абсорбции, должны обладать высокой абсорбционной способностью, быть избирательными, иметь низкое давление паров, быть нетоксичными, огне- и взрывобезопасными, иметь низкую стоимость и т.д.
Абсорбенты выбирают по растворимости в них поглощаемых компонентов.
Растворимость зависит от физико – химических свойств газа и жидкости, темпе-
ратуры системы и давления.
6.19 Уравнение равновесия фаз и рабочей линии
Если количество извлекаемого компонента мало, то процесс извлечения можно рассчитать графически, используя кривую равновесия
 . (6.101)
. (6.101)
Кривая равновесия строится на основе экспериментальных данных, либо расчетным путем.
Для нахождения рабочей линии абсорбции составим уравнение материального баланса процесса в абсолютных концентрациях по внешним потокам:
 . (6.102)
. (6.102)
Перепишем 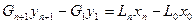 . (6.103)
. (6.103)
В относительных концентрациях это уравнение имеет вид
 , (6.104)
, (6.104)
откуда  , (6.105)
, (6.105)
Обозначим  -удельный расход абсорбента (6.106)
-удельный расход абсорбента (6.106)
Решая совместно уравнения (6.105) и (6.106), получим
 (6.107)
(6.107)
Запишем уравнения материального баланса по произвольному сечению
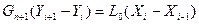 (6.108)
(6.108)
 (6.109)
(6.109)
Так как уравнения типа (6.109) можно составить для любого сечения колонны, то в общем виде удельный расход абсорбента равен  , т.е. удельный расход определяется разностью концентраций газовой и жидкой фаз.
, т.е. удельный расход определяется разностью концентраций газовой и жидкой фаз.
Так как потоки встречные, то уравнение (6.109) является математическим выражением рабочей линии абсорбции.
При абсорбции концентрация поглощаемого компонента в газе выше равновесной, поэтому на диаграмме X-Y рабочая линия располагается выше кривой равновесия и выражение движущей силы имеет вид
 , (6.110)
, (6.110)
где Y – изменяющая по высоте абсорбционного аппарата относительная концентрация извлекаемого компонента.
|
6.20 Расчёт абсорбции по диаграмме равновесных составов и по методу Кремсера
1) графически, по диаграмме равновесных составов
| |||
 | |||
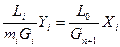 (6.114)
(6.114)
Обозначим - фактор абсорбции (6.115)
- фактор абсорбции (6.115)
Запишем уравнение равновесия по извлекаемому компоненту для произвольно выбранного i-го сечения
АiYi=lXi (6.116)
|
Генерация страницы за: 0.017 сек. |
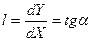 , (6.111)
Чем больше
, (6.111)
Чем больше 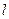 , тем больше
, тем больше 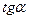 , тем меньше тарелок
, тем меньше тарелок
 (6.113)
(6.113)