
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Первый закон термодинамики
|
|
|
|
Общие закономерности химических процессов.
Тема 2. Химическая термодинамика и кинетика.
Метод солнечной дистилляции
Подавляющее большинство методов опреснения соленой воды требует значительных затрат тепловой или электрической энергии. Солнечная же дистилляция выгодно отличается от других методов опреснения, т.к. требует значительно меньших эксплуатационных расходов.
К недостаткам этого метода следует отнести:
1) большие капиталовложения в виду сложности конструкции и
слишком больших параметров.
2) изменения погоды и широта места затрудняют и ограничивают применение метода солнечной дистилляции.
2.1 Внутренняя энергия и энтальпия вещества. Первый закон термодинамики. Тепловые эффекты химических реакций. Экзо– и эндотермические реакции. Термохимические уравнения. Закон Гесса Движущие силы химического процесса. Понятие об энтропии. Направление самопроизвольного протекания химических реакций. Второй закон термодинамики. Энергия Гиббса.
Центральным в химии является учение о превращениях веществ, в том числе об энергетике и кинетике химических реакций. Усвоение этого учения позволит предсказать возможность и направление химических и физико-химических процессов, рассчитать энергетические эффекты и энергозатраты, скорость получения и выход продуктов реакции.
Основные понятия и определения.
Термодинамика - наука о превращении различных форм энергии.
Та область термодинамики, которая занимается изучением энергетических изменений в химических реакциях, называется химической термодинамикой.
Система - это часть пространства, заполненное веществом и отделенное от окружающей среды поверхностью раздела. Такой поверхностью может быть стенки сосуда.
Различают три вида системы:
1. открытые
2. закрытые
3. изолированные
Открытая - такая система, которая обменивается с окружающей средой веществом и энергией.
Закрытая - система, которая обменивается со средой только энергией.
Изолированная - не обменивается с окружающей средой ни веществом, ни энергией.
Реальные системы только приближаются к этим понятиям, но никогда
полностью не совпадают.
Параметры, описывающие состояние системы называется функциями состояния.
К таким функциям относятся:
| 1. внутренняя энергия | U | 3. энтропия | S |
| 2. энтальпия | Н | 4. энергия Гиббса | G |
В изолированной системе сумма всех видов энергии есть величина постоянная. Если к системе подведено некоторое количество теплоты Q, то оно может быть израсходовано на изменение внутренней энергии системы  и на совершение системой внешней работы А.
и на совершение системой внешней работы А.
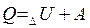 (1)
(1)
Под внутренней энергией системы U подразумевают ее общий запас, обусловленный всеми видами движений и взаимодействий состояний её молекул и атомов. В эту энергию включается поступательное, колебательное и вращательное движение молекул, атомов, ионов, энергии силового взаимодействия и все другие виды энергии, кроме кинетической (перемещение всей системы в целом) и потенциальной (взаимодействие с внешними силовыми полями).
В любом процессе приращение внутренней энергии равно:
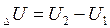 (2)
(2)
Если происходит химическая реакция, то работа совершается против внешних сил (давления):
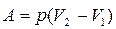 (3)
(3)
Подставим выражения 2 и 3 в формулу 1:

Выражение 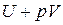 - энтальпия (H) или теплосодержание системы при
- энтальпия (H) или теплосодержание системы при
постоянном давлении.
Т.е. 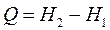
 - внутренняя энергия до реакции;
- внутренняя энергия до реакции;
 - внутренняя энергия после реакции;
- внутренняя энергия после реакции;
 - объём после реакции;
- объём после реакции;
 - объём до реакции;
- объём до реакции;
 - энтальпия системы после реакции;
- энтальпия системы после реакции;
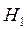 - до реакции;
- до реакции;
Н > 0 «+» - для эндотермических реакций (поглощение тепла).
Н < 0 «–» - для экзотермических (выделяется тепло).
Знак теплового эффекта определяется тем, с какой стороны рассматриваем процесс: со стороны окружающей среды, или изнутри химической системы. Если со стороны окружающей среды, то знак «+» соответствует экзотермическому процессу, когда среда получает тепло от химической системы. В дальнейшем мы будем пользоваться термодинамической системой знаков, то есть рассматривать процесс с точки зрения системы. Тогда экзотермической реакции будет соответствовать знак «–», поскольку система теряет энергию в виде тепла.
Экзотермический процесс 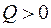
 ;
;
Эндотермический процесс 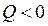
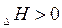 ;
;
С помощью изменения 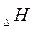 характеризуется не только реакции, но и отдельные соединения. Для этого применяется понятие о стандартной энтальпии образования
характеризуется не только реакции, но и отдельные соединения. Для этого применяется понятие о стандартной энтальпии образования  - это количество теплоты, которое выделяется или поглощается при образовании 1 моля cложного соединения из простых веществ (элементов), причем и само соединение и элементы находятся в том агрегатном состоянии, в котором они устойчивы, в так называемых стандартных условиях (при давлении
- это количество теплоты, которое выделяется или поглощается при образовании 1 моля cложного соединения из простых веществ (элементов), причем и само соединение и элементы находятся в том агрегатном состоянии, в котором они устойчивы, в так называемых стандартных условиях (при давлении  Па и при T= 298° К);
Па и при T= 298° К);
Измеряется в ккал/моль или кДж/моль;
Например: 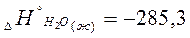 кДж/моль;
кДж/моль; 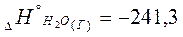
кДж/моль;
Обозначает, что при образовании 1 моля жидкой воды при стандартных условиях, выделяется -285,3 кДж тепла на каждый моль вещества.
Энтальпия простых веществ равна 0.
Экзотермические соединения более устойчивы, чем исходные простые вещества, так как при их образовании выделяется тепло.
Другим важным выражением закона сохранения энергии является закон Гесса.
|
|
|
|
Дата добавления: 2014-01-15; Просмотров: 417; Нарушение авторских прав?; Мы поможем в написании вашей работы!