
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изменение энтальпии в различных химических и физико-химических процессах
|
|
|
|
Обычно энтальпии образования имеют абсолютные значения от (±) сотен до нескольких тысяч кДж/моль. Стандартные значения энтальпий сгорания органических веществ имеют отрицательные значения. Фазовые переходы, при которых простое или сложное вещество переходит из одной твердой модификации в другую, обычно сопровождаются энергетическими эффектами порядка десятых долей единиц или нескольких десятков кДж/моль.
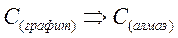 ;
; 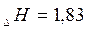 кДж/моль
кДж/моль
Любой человеческий организм является открытой термодинамической
системой. Основным источником энергии для него является химическая энергия, заключенная в пищевых продуктах, часть которой расходуется на:
1. совершение работы внутри организма, связанной с дыханием,
кровообращением;
2. нагревание вдыхаемого воздуха, потребляемой воды, пищи;
3. совершение внешней работы, связанной со всеми перемещениями человека и его трудовой деятельностью (при нормальной трудовой деятельности энергетические затраты человека покрываются за счет углеводов на 56 - 60 %, жиров на 20- 25 %, белков 15-20 %).
В процессе пищеварения углеводы разлагаются на глюкозу, которая растворяется в крови и реагирует с кислородом в несколько стадий.
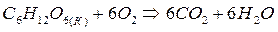
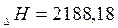 кДж
кДж
В связи с тем, что топливо и пища обычно представляют собой смеси, их теплотворная способность указывается в расчете не на 1 моль, а на 1 кг. Средняя калорийность углеводов 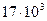 кДж/ кг, а жиров
кДж/ кг, а жиров 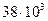 кДж/кг.
кДж/кг.
Суточная потребность человека в энергии составляет в среднем при умеренной и напряженной работе (лаборанты, врачи, учащиеся, студенты) 12500 -15100 кДж.
Направление самопроизвольно протекающих процессов. Движущие силы химического процесса. Понятие об энтропии.
Первое начало термодинамики утверждает, что все виды энергии взаимно превращаются в строго эквивалентных количествах. Но не даёт ответа на вопросы, почему процесс протекает именно в этом направлении, а не в обратном; настолько полно осуществляется превращение энергии из одного вида в другой.
|
|
|
Решение этих вопросов невозможно на основе первого начала, поэтому
используют иные термодинамические критерии.
В 1867 году Бертло сформулировал критерий возможности осуществления химических реакций:
1. Самопроизвольно могут протекать такие химические реакции,
которые сопровождаются выделением тепла.
Например:
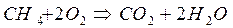 | 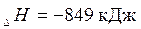 | |||||
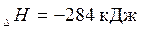 | ||||||
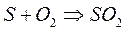 | ||||||
Но существуют самопроизвольные процессы, которые сопровождаются поглощением тепла. Это эндотермические реакции типа:
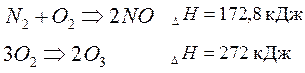 |
Очевидно, не одно только стремление системы свести к минимуму свой запас внутренней энергии, выделить избыток этой энергии в окружающую среду является движущей силой для самопроизвольного протекания химических и физико-химических процессов.
2. Стремление системы к максимальному беспорядку.
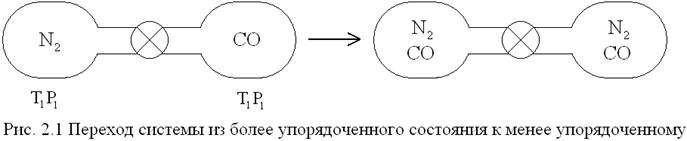
Например: имеются два газообразных баллона, соединенных трубкой с краном и заполненные не реагирующими друг с другом газами азотом и оксидом углерода СО, имеющими одинаковые t, Р и молекулярные массы. После открытия крана начинается активный процесс смешения газов. Наблюдается стремление системы к беспорядку.
Самопроизвольный процесс смешения газов в этом примере будет протекать без изменения энтальпии. Но обратный процесс разделения газов самопроизвольно протекать не будет: его можно осуществить, только затрачивая работу из вне. В самопроизвольных процессах система переходит от менее вероятного состояния к более вероятному.
 |
Мерой беспорядка системы служит энтропия S (Дж/моль·К);
|
|
|
|
|
Дата добавления: 2014-01-15; Просмотров: 1120; Нарушение авторских прав?; Мы поможем в написании вашей работы!