
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Анализ уравнения Гиббса
|
|
|
|
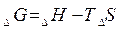
1. DH < 0 DS > 0, то DG < 0
экзотермическая - с увеличением энтропии - идет самопроизвольно;
2. DН > О DS < О, то DG > О
эндотермическая с уменьшением энтропии - реакция невозможна;
Во всех остальных случаях DН > О, DS > 0 и DH < 0 и DS < 0 знак DG будет зависеть от соотношения значений DН и DS.
а) При очень низких температурах
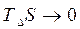 , тогда знак и величина DG определяется знаком и величиной DH;
, тогда знак и величина DG определяется знаком и величиной DH;
б) При обычных температурах величина ТDS для большинства реакций меньше DН поэтому при этих температурах экзотермические реакции (DН < О) протекают самопроизвольно, а эндотермические (DН > О) вынужденно.
Согласно уравнению DG=DН - ТDS при понижении температуры преобладает энтальпийный фактор, при повышении наоборот энтропийный. Вот почему при одних температурах реакция будет протекать слева направо (DG < О), а при других - справа налево DG> О. Т.е. процесс
неосуществимый;
в) При очень высоких температурах величина T∆S становится значительно больше DН и тогда знак DG определяется членом TDS
DG = -TDS
Следовательно, при очень высоких температурах энтропийный фактор преобладает, над энтальпийным. Поэтому для осуществления процессов ассоциации нужны низкие температуры, а для разложения - высокие температуры. При высоких температурах возможно самопроизвольное протекание эндотермических реакций.
г) Если соблюдается равенство DН = TDS, тo стремление частиц к упорядочению, определяемое величиной DН и стремление к беспорядку, определяемое величиной TDS, компенсируют друг друга т.е. совокупность веществ находится равновесии DG = О;
Таким образом необходимым условием протекания процесса является отрицательное по знаку изменения энергии Гиббса. Если DG>О, то такой процесс невозможен. При одинаковых знаках DН и DS, процесс обратимый DG=О.
2.2 Классификация химических реакций в химической кинетике. Гомо- и гетерогенные реакции. Скорость химической реакции. Факторы, влияющие на скорость химической реакции. Зависимость скорости химической реакции от концентрации реагирующих веществ. Закон действия масс. Константа скорости. Зависимость скорости реакции от температуры. Правило Вант – Гоффа.
Раздел химии, посвященный изучению скоростей и механизмов химических реакций называется химической кинетикой.
Скорость химических реакций изменяется в широких пределах. Так, для заверения химических процессов, происходящих при взрыве тротила, нитроглицерина, гремучей ртути и др. достаточно миллионных или даже десятимиллионных долей секунды, в то время как ощутимый результат ржавления железа можно обнаружить только за время, измеряемое сутками. Многие геохимические процессы, например превращение древесины в уголь, реализуется за промежутки времени, измеряемые миллионами лет.
|
|
|
|
|
Дата добавления: 2014-01-15; Просмотров: 1831; Нарушение авторских прав?; Мы поможем в написании вашей работы!